화학 방정식의 균형을 맞추려면 화살표의 양쪽에있는 각 요소의 원자 수를 계산하여 시작하십시오. 다음으로, 1 차 요소 (마지막으로 수소와 산소를 남겨두고)와 적절한 수를 곱하여 수소와 산소를 같은 방식으로 균형을 유지하십시오. .
성분이 올바른 비율로 추가되지 않으면 음식을 어떻게 맛볼까요?
나쁜? 어쩌면 멍청 할 수 없습니까?
음식과 유사하게, 화학 반응 (반응물)의 성분은 바람직한 제품을 형성하기 위해 올바른 비율로 존재해야합니다.
또한 질량 보존 법칙은 질량이 창조되거나 파괴 될 수는 없지만 재 배열 될 수 있다고 말합니다. 이것이 바로 화학 반응에서 발생하는 것입니다. 반응물 원자는 생산하기 위해 재 배열되어 각 요소의 양 (원자 수) 은이 재 배열 (반응)을 겪을 때 변하지 않습니다.
.따라서, 반응에 대한 화학 방정식을 작성할 때, 법을 따르고 각 요소의 원자 수는 방정식의 양쪽에서 동일하도록하는 것이 가장 중요합니다. 이것이 달성되면 반응은 균형을 이루고 있다고합니다.

Thanos와 마찬가지로 질량 보존 법칙은 모든 화학 방정식이 완벽하게 균형을 이루어야합니다.
화학 방정식은 무엇입니까?
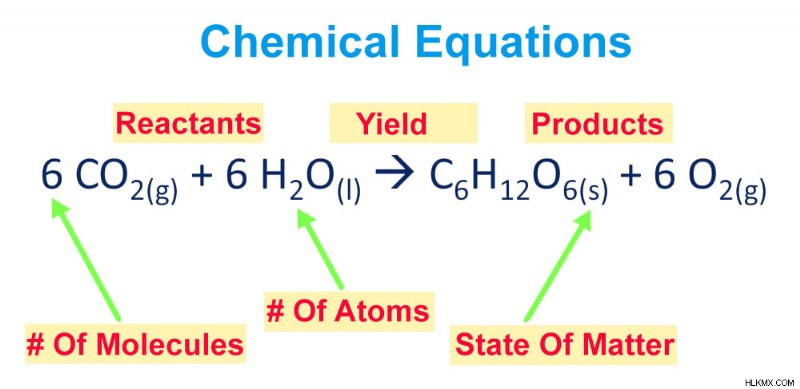
절차를 거치기 전에 화학 방정식을 해부하고 다양한 구성 요소에 대해 좀 더 익숙해 봅시다. 화학 방정식은 화학 반응을 설명하기 위해 깔끔하게 포장되어 화학적 기호와 숫자의 배열을 제시합니다.
화학 방정식은 반응물 절반과 제품 절반의 두 부분으로 그룹화 될 수 있습니다. 반응물 절반은 각각의 참여 반응물의 화학적 기호를 갖는 화살표의 왼쪽에있는 반면, 반응물의 반응에 의해 생성 된 생성물은 화살표의 오른쪽에 기록된다.
.
화학 방정식의 구성 요소
또한, 각 요소의 물리적 상태는 화학 기호/공식 후에 첨자 형식으로 언급됩니다. 구독에 대해 이야기하면 화학 기호 다음에 구독으로 작성된 숫자는 존재하는 요소의 원자 수를 나타냅니다.
각 화학 기호 이전에 부착 된 계수는 방정식의 균형을 맞추고 각 요소/화합물의 분자 수에 관한 정보를 전달하는 행위로 인해 발생합니다.
화학 방정식의 균형을 맞추는 방법?
방정식 균형은 뇌 수술과는 거리가 멀다. 숫자가있는 재능과 기본 단계를 따르는 능력 만 있으면됩니다. 절차는 반응 방정식의 검사로 시작합니다. 화살표의 양쪽에있는 각 요소의 원자가 계산됩니다. 동일하지 않다면 다음 단계가 균형을 맞추기 위해 수행됩니다.
1 단계 :각 요소의 원자 수
언급 한 바와 같이, 반응의 양쪽에 각 요소의 원자 수를 계산하고 언급하여 시작하십시오. 대기 질소와 수소의 반응을 고려해 봅시다. 두 사람은 암모니아 (NH3)를 생성하기 위해 반응하고 반응을 'Haber-Bosch 공정'이라고합니다. 이 반응의 불균형 방정식은 다음과 같습니다.
N2 + H2 → NH3
검사는 방정식이 2 개의 수소 원자와 결합하여 2 개의 질소 원자를 가지고있어 단일 분자의 암모니아를 생성한다는 것을 보여준다. 그러나, 암모니아는 3 개의 수소 원자를 갖는 반면, 반응물쪽에는 2가있다. 또한, 반응물 쪽은 생성물 측면보다 1 질소 원자가 더 많다. 분명히, 방정식은 균형이 맞지 않으며 질량 보존 법칙에 순종하지 않습니다. Thanos는 이것을 승인하지 않을 것이므로 스냅하기 전에 방정식의 균형을 맞추자!

2 단계 :기본 요소
부터 시작하십시오화학 방정식의 균형을 유지할 때는 항상 수소와 산소 원자를 마지막으로 두십시오 (종종 양쪽에 존재하기 때문에). 반응물 중 하나와 제품 중 하나에만 나타나는 요소로 시작하십시오.
이 예에서 수소 이외의 유일한 요소는 질소이므로 균형을 맞추겠습니다. 반응물 쪽은 2 개의 질소 원자를 갖는 반면, 생성물 측면에는 단일 원자가 있습니다. 단순히 암모니아에 2를 곱하면 질소 원자의 수의 균형을 유지합니다. 방정식은 이제 다음과 같습니다.
N2 + H2 → 2NH3
이제 우리는 양쪽에 2 개의 질소 원자가 있으므로 질소가 균형을 이룹니다. 다음 수소로 이동합시다.
작은 테이블도 업데이트합시다.

3 단계 :균형 수소 및 산소 원자
터미널 단계에서, 우리는 수소와 산소 원자의 균형을 유지합니다. 우리의 표에 따라, 수소 원자의 수는 6로 증가한 반면, 반응물 측은 여전히 2 개의 수소 원자를 갖는다. 2를 6으로 어떻게 변환 할 수 있습니까? 3을 곱하여. 그러니 그렇게합시다!
N2 + 3H2 → 2NH3
우리는 이제 양쪽에 6 개의 수소 원자가 있습니다. 따라서 수소도 균형을 이룹니다. 테이블은 이제 읽습니다.

모든 요소가 균형을 이루도록 최종 점검을 수행하겠습니다. 양쪽의 질소 원자의 수는 수소 원자의 수와 동일합니다. 따라서 우리의 화학 방정식은 완벽하게 균형을 이룹니다 (모든 것이 있어야합니다)
균형 잡힌 화학 방정식의 또 다른 예
또 다른 화학 반응을 고려하고 균형을 맞추십시오. 결국 연습은 완벽합니다. 광합성 반응은 어떻습니까? 반응에서, 이산화탄소 및 물은 서로 반응하여 포도당 (C6H12O6) 및 OH- 네밀한 산소를 생성한다. 불균형 방정식은 다음과 같습니다.
CO2 + H2O → C6H12O6 + O2

나중에 수소와 산소를 남겨두면 양쪽의 탄소 원자의 수를 균형을 맞추겠습니다. 반응물쪽에는 탄소 원자가 단지 1 개만 있고 생성물 포도당에는 6 개의 탄수화물이 있습니다. CO2를 6으로 곱하면 탄소 원자가 균형을 잡아야합니다. 따라서 :
6CO2 + H20 → C6H12O6 + O2

이제 수소로 이동합시다. 표에 따르면, 우리는 반응물쪽에 2 개의 수소 원자가 있고 그 중 12 개는 화살표의 반대편에 있습니다. H2O를 6으로 곱하면 수소의 균형을 잡을 것입니다.
6CO2 + 6H2O → C6H12O6 + O2

균형을 유지 해야하는 유일한 요소는 산소입니다. 반응물쪽에는 18 개가 있지만 제품 측에는 8 개만 있습니다. 포도당에 숫자로 곱하면 나머지 요소는 불균형이되므로 대신 산소의 솔로 분자에 중점을 두겠습니다.
이를 6 번으로 곱하면 총 12 개의 원자가 발생합니다. 이것들이 이미 기존 6 개의 산소 원자에 포도당에 첨가 될 때 방정식은 균형을 이룹니다.
6CO2 + 6H2O → C6H12O6 + 6O2

표에 따라 모든 요소는 이제 화살표의 반대쪽에 동일한 양으로 존재합니다. 따라서 우리의 방정식은 균형을 이룹니다.
최종 단어
방금 배운 방법 (검사 방법) 외에도 화학 방정식의 균형을 맞추기 위해 다른 두 가지 방법이 존재합니다. 첫 번째는 대수 방정식에 대한 지식과이를 해결하는 방법을 요구하는 반면, 다른 하나는 매트릭스를 사용하여 더욱 복잡한 경로를 취합니다. 그러나 검사 방법은 세 가지 중에서 가장 쉽고 모든 종류의 방정식의 균형을 맞추기 위해 적용 할 수 있습니다.
이 방법을 수행 할 때 기억해야 할 몇 가지 메모에는 다음이 포함됩니다. 첨자 숫자를 변경하여 방정식의 균형을 잡지 말고, 마지막으로 수소 및 산소 원자를 남겨두고, 하나의 반응물과 하나의 제품에만 나타나는 요소로 시작하고, 끝에서 단일/솔로 분자의 균형을 잡습니다.
.화학 방정식의 균형은 많은 화학적 특성의 계산의 첫 번째 단계입니다. 이 목록에는 반응에서 제한 반응물을 찾고 다른 많은 것들 중에서도 제품 수율 계산이 포함됩니다!