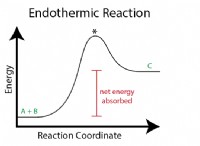
불소, 산소 및 염소의 경우 세 가지 요소 모두 같은 기간 (기간 2)에 속합니다. 불소는 맨 왼쪽에, 산소, 그리고 염소가 뒤 따릅니다. 따라서, 불소는 원자 수가 가장 낮고 가장 강한 핵 전하로 인해 산소 및 염소와 비교하여 가장 작은 원자 반경을 가지고 있습니다.
불소, 산소 및 염소의 원자 반경에 대한 요약은 다음과 같습니다.
- 불소 (F) :72 피코 미터 (PM)
- 산소 (O) :오후 73시
- 염소 (CL) :99 PM
보시다시피, 불소는 기간 동안 원자 반경을 감소시키는 경향과 일치하는 세 요소 중에서 가장 작은 원자 반경을 가지고 있습니다.