대부분의 실험실 환경에서 화합물을 반복해서 사용할 때 스톡 솔루션이 생성됩니다. 이 스톡 솔루션은 높은 농도를 가질 것입니다. 낮은 농도가 필요한 경우 희석이 수행됩니다.
희석은 용액을 더 첨가하지 않고 용액에 용매를 첨가하여 용액의 농도가 낮아지는 공정이다. 이러한 희석 예제 문제는 희석 된 용액을 만드는 데 필요한 계산을 수행하는 방법을 보여줍니다.
희석의 핵심 아이디어는 용매가 첨가 될 때 용액의 용질 몰의 수가 변하지 않는다는 것입니다.
희석 전 용질의 두더지 =희석 후 용질
용액의 농도는 어금니 (M)로 표현 될 수 있습니다.
M =용액 리터당 두더지

여기서 m은 몰라도이고 v는 농도입니다.
두더지를 해결하고 얻으십시오 :
Moles =mv
희석 전 용질의 두부 =희석 후 용질을 두더지하기 때문에
m i v i =m
어디:
m i =초기 농도
v i =초기 볼륨
m d =희석 된 농도
v d =희석 부피
예제 문제 1 :
문제 : 1 m naoh의 100 ml 용액을 생성하는 데 필요한 5 m Naoh의 부피는 무엇입니까?
솔루션 : 공식 m i 를 사용하십시오 v i =m
m i =5m
v i =초기 볼륨
m d =1 m
v d =100 ml
v i를 해결하십시오
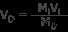

v i =20 ml
답변 : 1 m NaOH의 100 ml 용액을 생성하기 위해서는 5 m NaOH가 필요하다. 100 ml가있을 때까지 물이 20 ml 용액에 첨가됩니다.
예제 문제 2 :
문제 : 300 ml의 1.5 m NaCl을 가지고 있다면 0.25 m NaCl의 ml를 몇 ml로 만들 수 있습니까?
솔루션 : 공식 m i 를 사용하십시오 v i =m
m i =1.5 m
v i =300 ml
m d =0.25 m
v d =최종 볼륨
v d를 해결하십시오
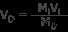

v d =1800 ml =1.8 l
답변 : 300 ml의 1.5 m NaCl 용액에서 1800 ml의 0.25 m NaCl 용액을 만들 수 있습니다.