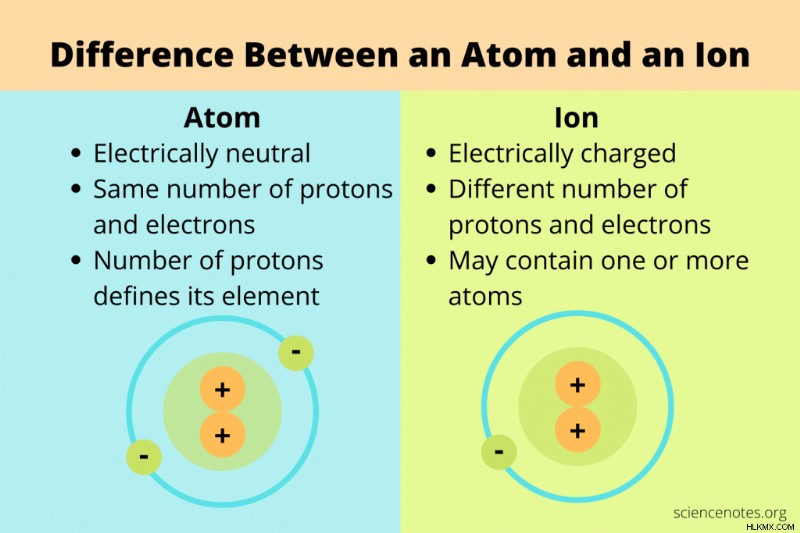
화학에서 원자와 이온의 주요 차이점은 원자가 중성 입자이고 이온은 양수 또는 음의 전하를 가지고 있다는 것입니다.
원자
원자 양성자, 중성자 및 전자로 만들어진 물질의 기본 빌딩 블록입니다. 요소의 정체성은 원자의 핵에서 양으로 하전 된 양성자의 수에 의해 결정됩니다.
일반적으로 화학자들이 원자에 대해 이야기 할 때, 동일한 수의 양성자와 전자를 함유하는 중성 입자를 의미합니다. 그러나, 원자의 더 넓은 정의에는 중성자 수 (동위 원소) 및 전자 (이온)의 가능한 모든 변화가 포함됩니다. 이 더 넓은 정의 하에서, 원자는 이온 일 수 있지만 모든 이온이 원자가되는 것은 아닙니다. 원자와 이온의 차이는 순 전하와 관련이 있습니다.
원자의 예로는 수소 (H), 헬륨 (HE), 철 (FE) 및 주기율표의 다른 요소가 포함됩니다.
이온
이온 순 양성 또는 음전하가있는 원자 또는 원자 수집입니다.
전자가 첨가되거나 제거되면, 중성 원자는 이온이된다. 전자가 제거되면 이온의 순 전하가 양수이며 양이온으로 알려져 있습니다. 전자가 첨가되면 이온의 순 전하는 음수이며 음이온으로 알려져 있습니다.
이온은 또한 원자 수집 일 수 있습니다. 원자가 결합 될 때 다 원자 이온이 형성되지만 원자 사이의 화학적 결합은 전하의 균형을 맞추지 않습니다.
다음은 이온의 몇 가지 예입니다.
- 불소 이온 :F -이 음이온에는 9 개의 양자와 10 개의 전자가 있습니다.
- 나트륨 이온 :NA -이 양이온에는 11 개의 양성자와 10 개의 전자가 있습니다.
- 구리 이온 :Cu 및 Cu -이 양이온에는 각각 29 개의 양성자와 28 및 27 전자가 있습니다.
- 암모늄 이온 :nh 4 -이 이온에는 순 전하가 +1 인 1 개의 질소와 4 개의 수소 원자가 들어 있습니다.
- 황산염 이온 :so 4 이 이온에는 순전하가 -2 인 1 개의 황 원자와 4 개의 산소 원자가 포함되어 있습니다.
- 아질산염 이온 :no
2 이 이온에는 -1의 순 전하에 대해 하나의 질소 원자와 2 개의 산소가 들어 있습니다.
더 많은 다 원자 이온은이 편리한 테이블을 확인하십시오.