질소는 주기율표의 일곱 번째 요소입니다. 이러한 질소 사실에는 일반 정보 및 이력과 함께 화학 및 물리적 데이터가 포함됩니다.

기본 질소 사실
이름 : 질소
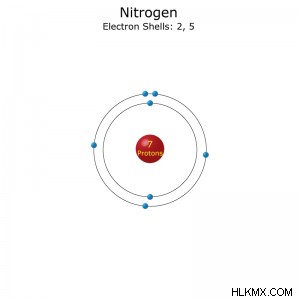
원자 번호 : 7
요소 기호 : n
그룹 : 15
기간 : 2
블록 : p
요소 가족 : 비금속
원자 질량 : [14.006 43; 14.007 28] IUPAC 지침. 단일 값의 경우 14.0067을 사용하십시오.
전자 구성 : [그는] 2S2P (속도) 또는 1S2S2P (Full)
발견 : 1772 년 다니엘 러더 포드
러더 포드의 교사 인 스코틀랜드 화학자 인 조셉 블랙 (Joseph Black)은 공기 화학을 연구하고있었습니다. 그가 인을 태워 산소를 제거했을 때. 그는 여전히 약간의 가스가 남아 있음을 발견했습니다. 이 미스터리는 그의 학생을위한 운동으로 남겨졌습니다. 러더 포드는 공기에서 이산화탄소를 제거함으로써 계속되었고 나머지 가스가 수명이나 추가 연소를 지원하지 않았다는 것을 보여 주었다. 그는 남은 공기가 물과 알칼리 솔루션에 불용성이라는 것을 발견했습니다. 그는 그의 공기를“유해한 공기”라고 불렀다.
이름 원산지 : 질소의 이름은 그리스어 단어 nitron 에서 유래합니다 및 유전자 각각 niter와 형성을 의미합니다. 1790 년 프랑스 화학자 Jean-Antoine-Claude Chaptal은 가스가 물질 Niter (질산 칼륨)의 일부임을 알았습니다. 프랑스 화학자 Antoine Lavoisier는 생명이없는 그리스어 단어 아조토스에서 가스 아 조테를 불렀습니다. 몇몇 국가는 여전히 질소에 대한 이름의 이름을 일반적으로 사용합니다.
동위 원소 :
천연 질소는 N-14 및 N-15의 두 가지 안정적인 동위 원소로 구성됩니다. 14 개의 다른 동위 원소는 N-10에서 N-25까지의 실험실 조건에서 생성되었습니다.
N
질소 -14는 7 개의 중성자를 함유하는 안정적인 동위 원소입니다. 천연 질소의 99.636%는 질소 -14입니다.
N
질소 -15는 8 개의 중성자를 함유하는 안정적인 동위 원소입니다. 천연 질소의 0.364%는 질소 -11입니다.

물리적 데이터
밀도 : 0.001145 g/cm
용융점 : 63.2k (-210.0 ºC 또는 -346.0 ºF)
끓는점 : 77.355 K (-195.795 ºC 또는 -320.431 ºF)
트리플 포인트 : 12.52 kPa에서 63.151 K
임계점 : 3.3958 MPa at 126.192 K
20ºC의 상태 : 가스
융합의 열 : n 2 의 경우 0.72 kj/mol
기화의 열 : n 2 의 경우 5.56 kj/mol
어금니 열 용량 : n 2 의 경우 29.124 J/mol · K
원자 데이터
원자 반경 : 1.55 Å
공유 반경 : 0.71 Å
van der waals 반경 : 1.55 Å
전자 친화력 : 안정적이지 않음
전기 음성 : (Pauling Scale) :3.04
1 이온화 에너지 : 1402.328 kj/mol
2 이온화 에너지 : 2856.092 kj/mol
3 이온화 에너지 : 4578.156 kj/mol
4 이온화 에너지 : 7475.057 kj/mol
5 이온화 에너지 : 9444.969 kj/mol
6 이온화 에너지 : 53266.835 kj/mol
7 이온화 에너지 : 64360.16 kj/mol
산화 상태 : +5, +3, -3 (공통), +4, +2, +1, -1, -2 (공통)

재미있는 질소 사실
- 질소는 무색, 맛이 없으며 무취 가스입니다.
- 질소는 본질적으로 단일 요소로 발견되지 않습니다. 그것은 규정형 화합물 n 2 를 형성하기 위해 그 자체로 결합합니다. .
- 질소 가스는 대기의 78%를 차지합니다.
- 암모니아를 생산하기 위해 약 4,900 만 톤의 질소가 대기에서 제거됩니다. 주기율표의
- 그룹 15는 질소 패밀리라고도합니다. 그룹의 오래된 이름은 Pnictogens였습니다. Pnictogen은 그리스어 단어 pnikta 에서 나온 것입니다 “질식하기”를 의미합니다.
- 질소는 산소로부터 상품을 보호하는 데 사용됩니다. 감자 칩 백의 '공기'는 대부분 질소입니다.
- 체중의 약 3%가 질소입니다. 또한 산소, 탄소 및 수소 후 인체에서 네 번째로 풍부한 요소입니다.
- 질소는 아미노산의 핵심 성분입니다. DNA의 모든 부분에는 질소가 있습니다.
- 질소 가스는 비교적 불활성입니다. 토양 박테리아는 식물이 자라기 위해 사용하는 형태로 질소를 '고정'할 수 있습니다.
- 질소는 생생한 오렌지-레드, 청록색, 청색-예 :Aurora의 깊은 바이올렛 색상을 담당합니다.
- 토성의 달 타이탄은 거의 전적으로 질소와 질소 화합물로 구성된 조밀 한 분위기를 가지고 있습니다. 황색 오렌지 안개 (그림 참조)는 대기에 매달린 탄화수소 스모그로 인해 발생합니다.
주기율표에서 요소에 대해 자세히 알아보십시오.