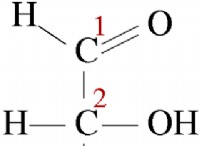
예를 들어, 염화나트륨 (NaCl)에서, 나트륨 이온은 +1의 전하를 가지며 클로라이드 이온은 -1의 전하를 갖는다. 이온 사이의 거리는 상대적으로 작기 때문에 그들 사이의 매력은 강합니다. 이 강력한 매력은 NaCl 화합물을 함께 유지하고 실온에서 고체로 만듭니다.
대조적으로, 요오드화 칼륨 (KI)에서, 칼륨 이온은 +1의 전하를 가지며 요오드화 이온은 -1의 전하를 갖는다. 그러나 Ki의 이온 사이의 거리는 NaCl의 이온 사이의 거리보다 큽니다. 이것은 Ki의 이온들 사이의 매력이 NaCl의 이온들 사이의 매력보다 약하다는 것을 의미합니다. 결과적으로 Ki는 실온에서 액체입니다.
따라서, 양이온과 음이온 사이의 관광 명소는 이온 성 화합물을 함께 유지한다. 이 관광 명소의 강점은 이온의 전하와 그들 사이의 거리에 달려 있습니다. 이온의 전하가 클수록 그들 사이의 거리가 작을수록 매력이 강하고 화합물이 더 단단히 고정됩니다.