스칸듐은 주기율표의 21 요소입니다. 이러한 스칸디움 사실에는 일반 정보 및 이력과 함께 화학 및 물리적 데이터가 포함됩니다.

기본 스칸듐 사실
이름 : 스칸디움
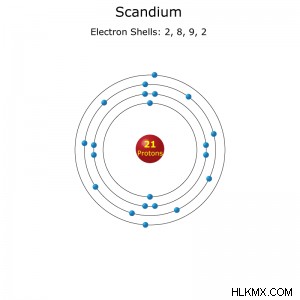
원자 번호 : 21
요소 기호 : Sc
그룹 : 3
기간 : 4
블록 : d
요소 가족 : 전이 금속
원자 질량 : 44.955 908 (5)
전자 구성 : [ar] 3d4sfull :1S2S2P3S3P3D4S (Full)
발견 : 1879 년 Lars Frederik Nilson
Mendeleev는 원자력에 차이가 있었기 때문에 칼슘과 티타늄 사이의 요소의 존재를 예측했습니다. 많은 화학자 들이이 요소를 찾기 시작했지만 스웨덴 화학자 인 Lars Nilson은 미네랄 Euxenite의 샘플에서 스칸디움을 추출했습니다. 그는 원자 중량이 약 44 인 Ytterbium의 산화물과 알려지지 않은 요소를 추출했습니다. 이것은 Mendeleev의 누락 된 요소에 속하는주기적인 테이블의 위치에 요소를 배치했습니다.
.이름 원산지 : Scandium은 Latin Scandia에서 이름을 얻습니다 스칸디나비아의 이름이었습니다.
동위 원소 :
천연 스칸듐은 하나의 안정적인 동위 원소 SC로 구성됩니다. SC에서 SC에 이르는 23 개의 방사성 동위 원소가 있습니다.
SC
Scandium-45는 24 개의 중성자를 함유하는 안정적인 동위 원소입니다. 천연 스칸듐의 100%는 Scandium-45입니다.

물리적 데이터
밀도 : 2.99 g/cm
용융점 : 1814 K (1541 ° C, 2806 ° F)
끓는점 : 3109 K (2836 ° C, 5136 ° F)
20ºC의 상태 : 단단한
융합의 열 : 14.1 kj/mol
기화의 열 : 332.7 kj/mol
어금니 열 용량 : 25.52 J/mol · K
원자 데이터
원자 반경 : 1.62 Å (경험적)
공유 반경 : 1.70 Å
van der waals 반경 : 2.11 Å
전자 친화력 : 18.139 kj/mol
전기 음성 : 1.36
1 이온화 에너지 : 633.088 KJ/mol
2 이온화 에너지 : 1234.99 KJ/mol
3 이온화 에너지 : 2388.655 kj/mol
4 이온화 에너지 : 7090.65 kj/mol
5 이온화 에너지 : 8842.88 kj/mol
6 이온화 에너지 : 10679 kj/mol
7 이온화 에너지 : 13315 kj/mol
8 이온화 에너지 : 15254.3 kj/mol
산화 상태 : +3 (공통), +2, +1 (드물게)

재미있는 스칸듐 사실
- 스칸듐은 실온에서 비교적 가볍고 부드러운 금속입니다. 공기에 노출되면 순수한 스칸듐은 분홍색 산화 층을 개발합니다.
- 스칸듐은 알루미늄과 매우 유사한 합금에 사용됩니다. Scandium은 거의 동일한 밀도를 갖는 반면 알루미늄보다 융점이 높습니다.
- 스칸디움은 희귀 한 지구 광석에서 종종 발견되기 때문에 희귀 한 지구 요소로 간주됩니다. 또한 다른 희귀 고리의 동일한 화학적 특성을 많이 공유합니다.
- 스칸디움은 지각에서 35 번째로 가장 풍부한 요소입니다.
- Scandium은 태양에서 23 번째로 가장 풍부한 요소입니다.
- 스칸듐은 전이 금속의 첫 번째입니다.
- Scandium-46은 지하 파이프에서 누출을 감지하는 추적자로 사용되는 방사성 동위 원소입니다. 그것은 또한 공정을 모니터링하기 위해 석유 정제에 사용됩니다.
- Scandium iodide는 수은 증기 조명에 사용되어 사진 및 필름을 위해 햇빛과 비슷한 빛을 생성합니다.
- 아쿠아 마린 보석과 관련된 색상은 스칸디움의 존재 때문입니다.
- 스칸듐은 우라늄 정제 중에 부산물로 생산됩니다.
주기율표에서 요소에 대해 자세히 알아보십시오.