원자의 핵은 양으로 하전 된 양성자와 중성 중성자로 구성되며, 음으로 하전 된 전자의 구름으로 둘러싸여 있습니다. 전자적으로 중성 원자는 같은 수의 양성자와 전자를 갖는다. 원자는 총 전자 수가 총 양성자 수와 같지 않으면 순 전하를 갖습니다.
이온은 양전하의 순전 또는 음수가있는 원자 또는 분자입니다. 단일 원자 이온은 단일 원자로 구성됩니다. 다 원자 이온은 둘 이상의 원자로 구성된다. 양성자의 양전하는 전자의 음전하와 같기 때문에 이온의 순 전하는 양성자 수와 동일합니다.
이온은 극도로 반응성 분자입니다. 그들은 주로 가스 상태에서 발견되며 지구상에서는 풍부하지 않습니다. 염이 액체 또는 고체 상태에서 용매와 상호 작용하면 이온이 생성됩니다. 전기 요금처럼 반대 충전이 그들을 끌어들이는 반대 충전은 그들을 끌어 들이고 있습니다.
이온의 유형
이온은 다양한 모양과 크기로 제공됩니다. 음이온은 양성자보다 전자가 많기 때문에 순 음전하가 있습니다. 양이온은 전자보다 더 많은 양성자를 가지고 있기 때문에 순 양전하가 있습니다. Zwitterions는 상이한 지점에서 양전하 및 음전하를 모두 갖는 중성 분자이다. 잉여 전자는 서로 저항하고 전자 구름의 물리적 크기에 추가되기 때문에 음이온은 종종 모 분자 나 원자보다 큽니다. 전자 구름의 크기가 감소하기 때문에 양이온은 종종 부모의 원자 나 분자보다 작습니다.
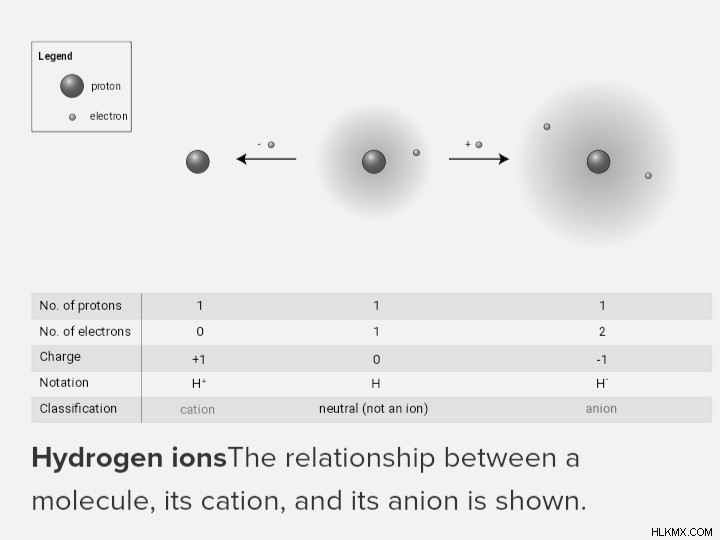
이 다이어그램은 분자, 양이온 및 음이온 사이의 상호 작용을 나타냅니다.
이온의 순 음성 전하는 원자/분자의 화학적 구조 바로 뒤에 슈퍼 스크립트로 작성됩니다. 단일 하전 된 분자/원자의 크기는 일반적으로 순전하가 부호 전 크기로 기록 될 때 생략됩니다. 로마 숫자는 때때로 모노 나이메이미 이온을 나타내는 데 사용되며, 슈퍼 스크립트 숫자는 순 전하 및 요소의 공식적인 산화 상태를 나타냅니다. 예를 들어 Fe2+를 Fe (II)라고 할 수 있습니다. 모노 토미 이온의 경우, 이들 표현은 동일하다. 그러나 로마 숫자는 다 원자 이온에 사용할 수 없습니다.
형성 이온
이온화는 중성 원자가 전자를 잃거나 얻는 과정으로, 이온이 형성됩니다. 외부 껍질 전자는 양으로 하전 된 핵에 더 단단히 결합되어 이러한 유형의 화학적 상호 작용에 참여하지 않습니다. 내부 껍질 전자는 양으로 하전 된 핵에 더 단단히 결합되어 이러한 유형의 화학적 상호 작용에 참여하지 않습니다.
이온화는 원자 또는 분자 사이에서 전자를 교환하는 과정입니다. 이 과정은 가장 안정적인 원자와 이온의 가장 바깥 쪽 (원자가) 쉘에 8 개의 전자가 있음을 명시하는 옥트 규칙과 같은보다 안정적인 전자 구성을 달성하려는 욕구에 의해 동기가 부여된다. 다 원소 성 및 분자 이온은 또한 H+와 같은 중성 분자에서 원소 이온을 얻거나 잃어 버림으로써 형성 될 수있다. 다 원자 이온은 매우 불안정하고 반응성이 높은 것으로 유명합니다.
na+는 이온의 일반적인 예입니다. 나트륨은 11 개의 전자를 가지고 있기 때문에 양전하가 있습니다. 반면, 나트륨은 옥트 규칙에 따라 10 개의 전자로 더 안정적 일 것입니다 (가장 안쪽 쉘의 2, 가장 바깥 쪽 쉘에서 8). 결과적으로, 나트륨은 더 안정되기 위해 전자를 잃습니다. 반면에 염소는 하나의 전자를 얻고 Cl-을 형성하는 경향이 있습니다. 염소는 본질적으로 17 개의 전자를 가지지 만, 18 개의 전자 (가장 안쪽 쉘에서 2 개, 두 번째 쉘에서 8 개, 원자가 쉘에서 8 개)가 있으면 더 안정적입니다. 결과적으로 염소는 다른 원자에서 전자를 훔쳐서 음전하를 얻습니다.
결론
우리는 원자의 양성자 양이 전자의 수와 같지 않을 때 이온이 발생한다고 결론 지었다. 전자보다 더 많은 양성자가있는 경우, 이온은 양이온이라고합니다. 더 많은 전자가 있다면 이온을 음이온이라고합니다.
이온은 극도로 반응성 분자입니다. 그들은 주로 가스 상태에서 발견되며 지구상에서는 풍부하지 않습니다. 전기 충전처럼 반대하는 반대 요금은 그들을 끌어 들이고 있습니다.
원자의 크기는 전자 구름에 의해 결정됩니다. 더 많은 전자 (음이온)는 전자 반발을 향상시켜 더 큰 이온을 생성하는 반면, 양이온 (전자가 적음)은 구름에 서로를 거부 할 전자가 적기 때문에 원자보다 작습니다.