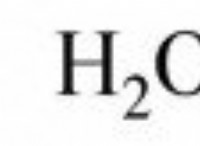
반응물 중 하나가 떨어질 때까지 많은 화학 반응이 발생합니다. 이 반응물은 제한 반응물로 알려져 있습니다. 종종 어떤 반응물이 제한 반응물이 될지 결정하는 것이 간단하지만 때로는 몇 단계가 더 걸립니다.
예를 들어 그릴에서 프로판을 태우십시오. 공기 연소의 프로판과 산소는 열과 이산화탄소를 생성합니다. 공기 중에 산소가 떨어지기 오래 전에 프로판이 부족할 가능성이 더 높습니다. 이것은 프로판을 제한 반응물로 만듭니다. 다른 반응은 쉽지 않습니다.
이 예제 문제는 제한 반응물을 결정하기 위해 균형 화학 방정식에 주어진 반응물 사이의 화학량 론적 비율을 사용하는 방법을 보여줍니다.
.제한 반응물 예
을 찾으십시오질문 : 암모니아 (nh 3 ) 질소 가스 (n 2 )는 수소 가스와 결합된다 (H 2 ) 반응에 의해
n 2 + 3 h 2 → 2 nh 3
50 그램의 질소 가스와 10 그램의 수소 가스가 함께 반응하여 암모니아를 형성합니다. 두 가스 중 어느 것이 먼저 다 떨어질까요? (어떤 가스는 제한 반응물입니까?)
답변 : 반응은 n 2 의 모든 두더지에 대해 우리를 보여줍니다 소비, 3 몰의 H 2 또한 소비됩니다. 질소 가스의 모든 두더지마다 3 몰의 수소 가스가 필요합니다. 우리가 알아야 할 첫 번째는 각 가스의 두더지 수가 있습니다.
N2 가스 : 50 그램의 질소 가스는 몇 개입니까? 1 몰의 질소는 14.007 그램이므로 n < 2 의 1 몰 무게는 28.014 그램입니다.
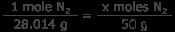
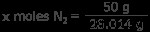
x 몰스 n 2 =1.78
h 2 가스 : 10 그램의 수소 가스는 몇 몰입니까? 수소의 1 몰은 1.008 그램이므로 1 몰의 H2는 2.016 그램입니다.
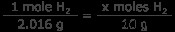
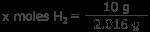
x 몰스 H 2 =4.96
이제 우리는 각 반응물의 수를 알면 화학 방정식의 비율을 사용하여 양을 비교할 수 있습니다. 수소 가스와 질소 가스의 비율은 다음과 같습니다.

우리가 h 2 의 두더지를 나누면 n 2 의 두더지로 , 우리의 가치는 어떤 반응물이 짧게 될지 알려줄 것입니다. 상기 비율보다 큰 값은 상단 반응물이 더 낮은 수에 초과 함을 의미합니다. 비율보다 작은 값은 상단 반응물이 제한 반응물임을 의미합니다. 열쇠는 위의 단계와 동일한 반응물을 맨 위에 두는 것입니다.

2.79
우리의 값은 이상적인 비율보다 작기 때문에 최고 반응물은 제한 반응물입니다. 우리의 경우, 최고 반응물은 수소입니다.
답변 : 수소 가스는 제한 반응물입니다.
계산 전체에서 동일하게 유지하는 한이 유형의 문제를 수행 할 때 어떤 반응물을 맨 위에 놓는지는 중요하지 않습니다. 만약 우리가 수소 대신 질소 가스를 상단에 놓았다면 비율은 같은 방식으로 해결되었을 것입니다. 이상적인 비율은 ⁄ 3 일 것입니다 계산 된 비율은 0.358 ( /4.96 입니다. ). 값은 이상적인 비율보다 클 것이므로 비율의 바닥 반응물은 제한 반응물이 될 것입니다. 이 경우 수소 가스입니다.