루이스 산 및 염기 이론은 전자를 산-염기 반응에서 활성 종으로 본다. 루이스 산 Lewis Base 반면 전자 쌍 수용체입니다 전자 쌍 기증자입니다. 이것은 수소 이온 또는 양성자의 거동으로부터 각각 반응을 본다. 루이스 이론의 장점은 산과 염기 목록을 확장하고 산화 감소 반응과 잘 어울린다는 것입니다.
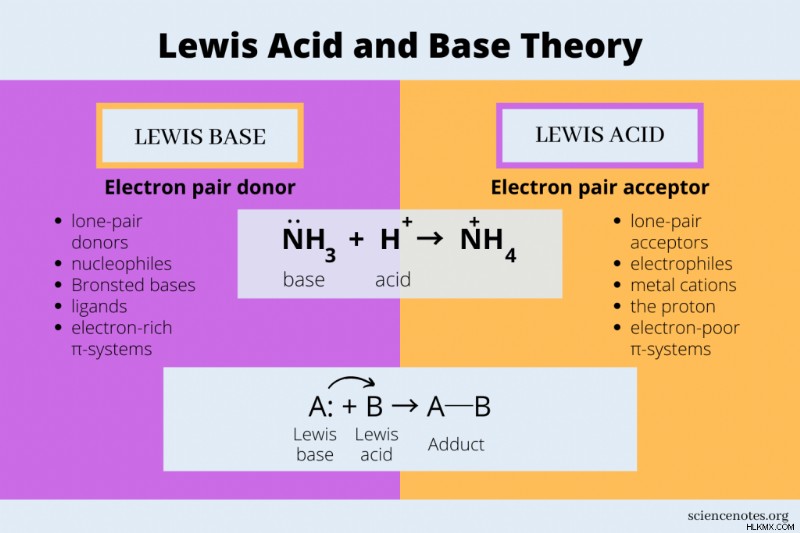
- 루이스 산은 전자 쌍을 수용하여 공유 결합을 형성합니다.
- 루이스베이스는 전자 쌍을 기증하여 공유 결합을 형성합니다.
역사
미국의 물리 화학자 Gilbert N. Lewis는 화학 결합에 대한 이해를 그의 산베이스 이론에 적용했습니다. 1916 년, 루이스는 각 원자가 하나의 전자를 기여할 때 공유 결합이 형성되어 원자가 공유하는 전자 쌍을 형성 할 것을 제안했다. 두 전자가 하나의 원자에서 오면 화학 결합은 좌표 또는 공유 결합입니다. 1923 년에 루이스는 산을“자체 원자 중 하나의 안정적인 그룹을 완성 할 때 다른 분자로부터 전자 고독한 쌍을 사용할 수있는 물질”이라고 묘사했다. 1963 년, 이론은 단단하고 부드러운 산과 염기를 분류하기 위해 확장되었습니다 (HSAB 이론)
루이스 산과베이스가 어떻게 작동하는지
루이스 산-염기 반응은 염기에서 산으로 한 쌍의 전자를 전달하는 것을 포함한다. 예를 들어, 암모니아의 질소 원자 (NH <서브> 3 )에는 전자 쌍이 있습니다. 암모니아가 수소 이온 (H)과 반응 할 때, 전자 쌍은 수소로 전달되어 암모늄 이온을 형성한다 (NH 4 ).
nh 3 + h → nh 4
따라서 암모니아는 루이스베이스이고 수소 양이온은 루이스 산입니다. Arrhenius와 Bronsted Lowry 이론은 모두이 산-염기 반응을 설명합니다.
그러나 루이스 산 및 기본 이론은 또한 수소를 함유하지 않는 산을 허용합니다. 예를 들어, 붕소 트리 플루오 라이드 (bf 3 )는 암모니아와 반응 할 때 루이스 산입니다 (다시 한번 루이스베이스) :
nh 3 + bf 3 → nh 3 bf 3
질소는 전자 쌍을 붕소 원자에 기증합니다. 두 분자는 부가 물의 직접 결합하여 형성합니다 . 두 종 사이에 형성되는 결합은 좌표 결합 입니다. 또는 공유 공유 결합 .
루이스 산 및 염기의 예
루이스베이스에는 다른 정의에 따라 일반적인베이스가 포함됩니다. 루이스베이스의 예로는 OH, NH 3 가 포함됩니다 , CN 및 H 2 O. Lewis 산에는 일반적인 산과 다른 정의에서 산으로 보이지 않는 종이 포함됩니다. 루이스 산의 예로는 H, HCl, Cu, Co 2 가 포함됩니다 , sibr 4 , alf 3 , bf 3 , h 2 o.
| Lewis acids | Lewis bases |
| lone-pair acceptors | lone-pair 공여자 |
| electrophiles | nucleophiles |
| 금속 양이온 (예 :Ag, Mg) | Bronsted-Lowry Bases |
| 양성자 (h) | 리간드 |
| electron-poor π-systems | 전자가 풍부한 π-systems |
단단하고 부드러운 루이스 산 및 염기 (HSAB 이론)
루이스 산과베이스는 경도 또는 부드러움에 따라 분류됩니다. 하드는 작고 편광 할 수없는 것을 의미합니다. 소프트는 더 크고 분극 가능한 원자에 적용됩니다.
- 단단한 산의 예는 H, 알칼리 금속 양이온, 알칼리성 지구 금속 양이온, Zn, 보란입니다.
- 연질 산의 예는 Ag, Pt, Ni (0), Mo (0).
입니다 - 전형적인 단단한 염기는 암모니아, 아민, 물, 불소, 염화물 및 카르 복실 레이트입니다.
- 연질 염기의 예는 일산화탄소, 요오드화물, 티오 에테르 및 유기 인 인간입니다.
HSAB 이론은 부가 구조 형성의 강도 또는 변환 반응의 산물을 예측할 때 도움이됩니다. 하드 하드 상호 작용은 엔탈피 맛이 있습니다. 소프트-소프트 상호 작용은 엔트로피 선호입니다.
양서류 종
일부 화학 종은 수륙 양용이며, 이는 상황에 따라 루이스 산 또는 루이스베이스로 작용할 수 있음을 의미합니다. 물 (h 2 o) 좋은 예입니다.
물은 암모니아와 반응 할 때 산 역할을합니다.
H 2 o + nh 3 → nh 4 + 오
그것은 염산과 반응 할 때베이스 역할을합니다.
H 2 O + HCL → CL + H 3 o
수산화 알루미늄 [Al (OH) 3 ]는 루이스 이론에 따른 수륙 양용 화합물의 예입니다. 그것은 수소 이온과의 반응에서 루이스베이스 역할을합니다 :
al (OH) 3 + 3H → Al + 3H 2 o
수산화 이온과의 반응에서 루이스 산 역할을합니다.
.
al (OH) 3 + OH → AL (OH) 4
루이스 산 및 염기 대 청동 고유 산 및 염기
산과 염기의 청동 고장 이론은 루이스 이론과 같은 해에 출판되었습니다. 두 이론은 다른 기준을 사용하여 산과 염기를 예측하지만 대부분 산과 염기 목록은 동일합니다.
모든 Bronsted Lowry 기지는 Lewis 기지입니다. 모든 기관지 용량 산은 루이스 산입니다. 또한, 브론 스테드-로운 산의 컨쥬 게이트베이스는 루이스베이스입니다. 그러나, 브론 스테드 로유한 산이 아닌 일부 루이스 산이 있습니다. 또한, 일부 루이스베이스는 쉽게 양성자가 아니지만 루이스 산과 반응합니다. 예를 들어, 일산화탄소 (CO)는 매우 약한 브론 스 테드 끈베이스 인 루이스베이스입니다. 일산화탄소는 불화 베릴륨으로 강한 부가 물을 형성한다 (bf 3 ).
참조
- Carey, Francis A. (2003). 유기 화학 (5th ed.). 보스턴 :맥그로 힐. ISBN 0-07-242458-3.
- iupac (1997). "루이스 산". 화학 용어의 개요 (2 판) (“골드 북”). 블랙웰 과학 간행물. doi :10.1351/goldbook.l03508
- 젠슨, W.B. (1980). Lewis Acid-Base 개념 :개요 . 뉴욕 :와일리. ISBN 0-471-03902-0.
- Lepetit, Christine; 마라발, 발레리; 카나, 이브; Chauvin, Remi (2016). “Dative Bond의 본질 :금속과 그 너머의 조정. 탄소 케이스”. 조정 화학 검토 . 308 :59–75. doi :10.1016/j.ccr.2015.07.018
- Lewis, Gilbert Newton (1923). 원자가 및 원자 및 분자의 구조 . 미국 화학 학회. 모노 그래프 시리즈. 뉴욕, 뉴욕, 미국 :화학 카탈로그 회사. ISBN 9780598985408.