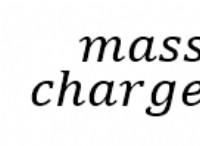
전자 친화력 ( e
- 전자 친화력은 원자가 전자를 얻을 때 에너지 변화입니다.
- 고귀한 가스를 제외한 대부분의 요소의 경우, 이것은 발열 과정입니다.
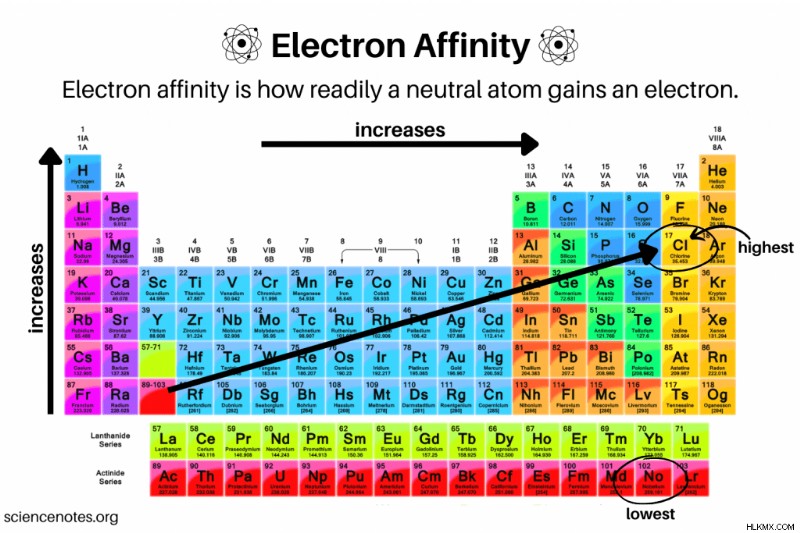
- 전자 친화도는 기간에 걸쳐 이동하는 것을 증가시키고 때로는 그룹 아래로 이동하는 것을 감소시킵니다.
- 전자 친화력이 기간 동안 이동하는 이유는 효과적인 핵 전하가 증가하여 전자를 끌어 들이기 때문입니다.
역사
1934 년, Robert S. Mulliken은 전자 친화력을 적용하여 주기율표의 원자에 대한 전기 음성 척도를 나열했습니다. 전자 화학 전위 및 화학적 경도는 또한 전자 친화력의 원리를 사용합니다. 다른 원자보다 더 양의 전자 친화력 값을 가진 원자는 전자 수용체이고, 값이 낮은 값을 가진 사람은 전자 공여체입니다.
전자 친화력이 작동하는 방법 (부호 규칙)
원자는 전자를 얻거나 잃거나 화학 반응에 참여할 때 에너지를 얻거나 잃습니다. 에너지 변화의 부호는 전자를 부착하거나 제거하는지 여부에 따라 다릅니다. 에너지 변화에 대한 표시 (Δ e 이기 때문에 치료를 사용하십시오. )는 전자 친화력의 부호와 반대입니다 ( e
e
전자 부착 :
- 원자가 에너지를 방출 할 때 반응은 발열입니다. 에너지의 변화 Δ e 음의 부호와 전자 친화력 e 가 있습니다
ea 긍정적 인 징후가 있습니다. - 원자가 에너지를 흡수 할 때 반응은 흡열입니다. 에너지의 변화 Δ e 양성 부호와 전자 친화력 e 을 갖는다
ea 부정적인 징후가 있습니다.
고귀한 가스를 제외하고주기적인 표에있는 대부분의 원자에 대한 전자 친화력은 발열 성입니다. 기본적으로 전자를 부착하려면 에너지가 필요합니다. 따라서 대부분의 원자에 대해 Δ e 음수이고 e 입니다
그러나 , 일부 테이블은 제거 에 대한 값을 나열합니다 전자의 포획보다는 중성 원자로부터의 전자의 전자. 에너지 값은 동일하지만 부호는 역전됩니다.
주기율표의 전자 친화력 추세
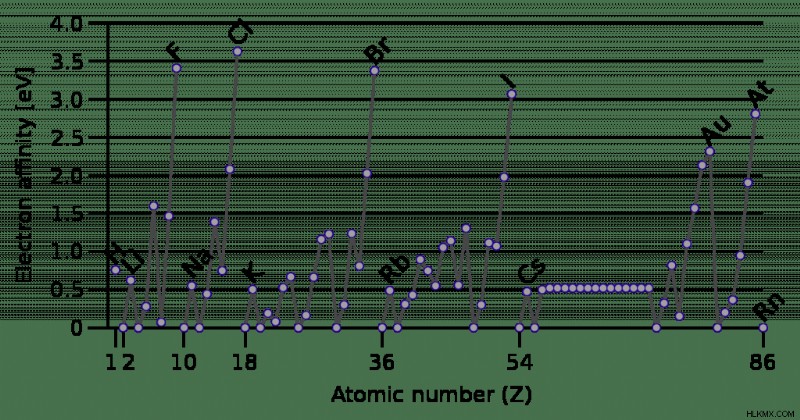
전기 음성, 이온화 에너지, 원자 또는 이온 반경 및 금속 특성과 마찬가지로 전기 음성 성은 주기적 테이블 경향을 나타냅니다. 이러한 다른 특성들과 달리 전자 친화력에 대한 경향에는 많은 예외가 있습니다.
- Electron Cafinity General은 주기성 테이블의 행 또는 기간을 가로 질러 이동하는 것을 증가시킵니다 , 그룹 18 또는 고귀한 가스에 도달 할 때까지. 이것은 원자가 전자 쉘의 충전으로 인해 기간을 가로 질러 이동하기 때문입니다. 예를 들어, 그룹 17 (할로겐) 원자는 전자를 얻어서 더 안정적이 된 반면, 그룹 1 (알칼리 금속)은 안정적인 원자가 쉘에 도달하기 위해 여러 전자를 추가해야합니다. 또한, 기간 동안 이동함에 따라 효과적인 핵 전하가 증가합니다.
- 고귀한 가스는 전자 친화도가 낮습니다.
- 일반적으로 (예외와 함께) 비금속은 더 양수 또는 더 양의 e ea 를 갖는다. 금속보다 가치.
- 중성 원자보다 더 안정적 인 음이온을 형성하는 원자는 전자 친화력이 높습니다.
- 일반적으로 주기적 테이블 트렌드의 다이어그램에 묘사되지만 Electron Affinity는 not 입니다. 열이나 그룹 아래로 이동하는 것을 안정적으로 감소시킵니다. 그룹 2 (알칼리성 지구 금속)에서, e ea 주기율표 아래로 이동하면 실제로 증가합니다.
전자 친화력과 전기 음성 성의 차이
전자 친화력과 전기성은 관련 개념이지만 같은 의미는 아닙니다. 어떤면에서, 둘 다 전자를 유치하는 원자의 용량을 측정 한 것입니다. 그러나 전자 친화도는 전자를 수용 할 때 기체 중성 원자의 에너지 변화이며, 전기 음성은 원자가 화학적 결합을 형성 할 수있는 한 쌍의 전자 쌍을 얼마나 쉽게 끌어 올리는지를 측정하는 것입니다. 두 값은 다른 단위와 다소주기적인 테이블 트렌드를 가지고 있습니다.
| 전기 음성 | 전자 친화력 | |
|---|---|---|
| 정의 | 전자를 유치하는 원자의 능력 | 중성 원자 또는 분자를 받아 들일 때 방출되거나 흡수되는 에너지 양 |
| 응용 프로그램 | 단일 원자 만 | 일반적으로 단일 원자이지만 개념은 분자 | 에도 적용됩니다.
| 단위 | Pauling Units | kj/mol 또는 ev |
| 속성 | 정성 | 정량적 |
| 주기적 테이블 트렌드 | 기간에 걸쳐 왼쪽에서 오른쪽으로 이동하는 것을 증가시킵니다 (고귀한 가스 제외) 그룹 | 아래로 이동하는 것을 감소시킵니다 기간에 걸쳐 왼쪽에서 오른쪽으로 이동하는 것을 증가시킵니다 (고귀한 가스 제외) |