주요 차이 - 원자 번호 대 원자력
원자는 모든 문제가 만들어지는 기본 단위입니다. 과학적 발견은 원자가 전자, 양성자 및 중성자와 같은 아 원자 입자로 더 나눌 수 있음을 보여 주었다. 또한 원자는이 핵을 주위로 움직이는 핵 및 전자라는 중심 코어를 갖는 복잡한 구조를 갖는 것으로 밝혀졌다. 핵에는 양성자와 중성자가 포함되어 있습니다. 원자 수와 원자 중량은 원자와 그 질량에 존재하는 아 원자 입자의 수를 설명하는 데 사용되는 두 가지 화학 용어입니다. 원자 수와 원자 중량의 주요 차이점은 원자 수가 핵에 존재하는 양성자 수를 제공하는 반면 원자 중량은 원자의 질량을 제공한다는 것입니다.
주요 영역을 다루었습니다
1. 원자 번호
- 정의, 설명
2. 원자 무게
- 정의, 설명
3. 원자 수와 원자력의 차이는 무엇입니까
- 주요 차이점 비교
주요 용어 :원자, 원자 번호, 원자 중량, 전자, 중성자, 핵, 양성자

원자 번호
원자 번호는 원자의 핵에 존재하는 총 양성자 수입니다. 양성자는 원자의 핵에 있습니다. 원자의 양성자 수는 화학 요소의 독특한 특성입니다. 따라서, 우리는 원자에 존재하는 양성자 수를 찾아서 주어진 화학 요소를 식별 할 수 있습니다. 각각의 모든 원자에는 하나 이상의 양성자가 있습니다. 예를 들어, 수소 원자에는 하나의 양성자 만 있습니다.
원자 번호는 단위가없는 척도입니다. 동위 원소는 양성자 수가 다르지만 다른 수의 중성자를 갖는 원자입니다. 이들 동위 원소는 수의 양성자 수를 가지기 때문에 동일한 화학 요소에 속합니다. 따라서 동위 원소에 대해 이야기 할 때 원자 번호가 동일한 동일한 요소의 다른 형태에 대해 이야기하고 있습니다.
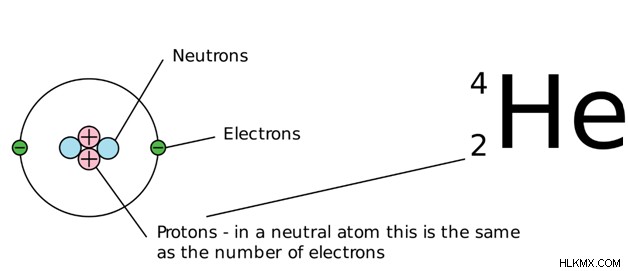
그림 1 :헬륨의 원자 수는 2입니다. 헬륨 핵에는 두 개의 양성자가 있습니다.
중성 원자의 경우, 핵의 양성자 수는 핵 주위의 전자 수와 같습니다. 따라서 특정 요소의 원자 수는 해당 요소의 중성 원자에 존재하는 전자의 수를 나타냅니다.
해당 요소가 방사성 인 경우 요소의 원자 번호를 변경할 수 있습니다. 이것은 일부 요소가 방사능을 겪을 때 양성자가 상이한 아 원자 입자로 전환되거나 중성자가 양성자로 전환 될 수 있기 때문이다. 어느 쪽이든, 그것은 원자에 존재하는 양성자의 수를 변경합니다. 이것은 다른 요소로 변경됩니다 (원자 번호의 변화는 요소를 변경합니다).
원자 무게가 무엇인가
원자의 원자 중량은 동위 원소의 상대적 풍부도를 사용하여 계산되는 특정 요소의 원자의 평균 질량입니다 (동일한 수의 양성자를 갖지만 다른 수의 중성자 수). 원자의 원자 중량은 원자 수와 핵에 존재하는 중성자의 수에 따라 다릅니다. 전자의 질량은 상당히 작기 때문에 무시할 수 있습니다. 따라서 원자량은 전자의 수에 의존하지 않습니다.

그림 2 :염소의 원자 중량
단위 원자 중량은 지상 상태에서 Carbon-12 동위 원소의 무게의 12 분의 1로 계산됩니다. 이 탄소 -12 원자에는 12 개의 원자 질량 단위가 있습니다. 예를 들어 보겠습니다.
염소의 원자 중량 (CL) :
염소의 가장 풍부한 동위 원소는 CL-37, CL-36 및 CL-35입니다.
| 동위 원소 | 풍부 (%) | 질량 (amu) |
| CL-35 | 76 | 34.96 |
| CL-37 | 24 | 36.96 |