분자간 힘은 이웃 분자들 사이에서 작용하는 대화식 힘입니다. 강한 이온-쌍극자 상호 작용, 쌍극자 쌍극자 상호 작용, 런던 분산 상호 작용 또는 유도 쌍극자 결합과 같은 여러 유형의 분자간 힘이 있습니다. 이러한 분자간 힘 중에서 런던 분산 세력과 쌍극자 쌍극자 힘은 반 데르 발스 세력의 범주에 속합니다.
이 기사는
를 봅니다 1. 쌍극자 쌍극자 상호 작용이란 무엇입니까
2. 런던 분산 상호 작용은 무엇입니까
3. 반 데르 발스 (Van der Waals)의 힘은 어떻게 분자를 함께 유지합니까
쌍극자 쌍극자 상호 작용이란 무엇입니까
다른 전기성의 두 원자가 한 쌍의 전자를 공유 할 때 전기 음성 원자가 한 쌍을 그 자체로 끌어냅니다. 따라서, 약간 음수 (Δ-)가되어 덜 전기 음성 원자에서 약간 양전하 (Δ+)가 유도됩니다. 이를 위해서, 두 원자 사이의 전기 음성 차이는> 0.4 여야한다. 전형적인 예는 다음과 같습니다.

그림 1 :쌍극자 쌍극자 상호 작용의 예
cl은 h보다 전기 음성 (전기 음성 차이 1.5)입니다. 따라서, 한 쌍의 전자는 Cl에 더 편향되어 Δ-가된다. 분자 의이 Δ- 말단은 다른 분자의 Δ+ 말단을 끌어내어 둘 사이에 정전 기적 결합을 형성한다. 이런 종류의 결합을 쌍극자-다이폴 본드라고합니다. 이 결합은 분자 주변의 비대칭 전기 구름의 결과입니다.
수소 결합은 특별한 종류의 쌍극자-쌍극자 결합입니다. 수소 결합이 발생하기 위해서는 수소 원자에 고도로 전기 음성 원자가 부착되어야합니다. 그러면 공유 된 한 쌍의 전자 쌍이보다 전기 음성 원자를 향해 당겨집니다. 고독한 전자 쌍이있는 전기 음성 원자가있는 이웃 분자가 있어야합니다. 이것을 수소 공여체로부터 전자를 받아들이는 수소 수용체라고합니다.
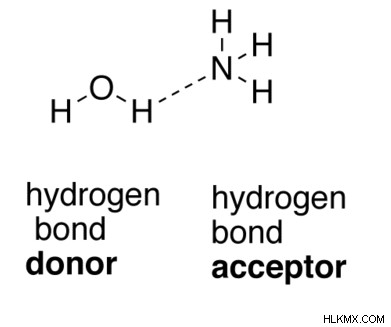
그림 2 :수소 결합
위의 예에서, 물 분자의 산소 원자는 수소 공여체로서 동작한다. 암모니아 분자의 질소 원자는 수소 수용체입니다. 물 분자의 산소 원자는 암모니아 분자에 수소를 기증하고 쌍극자 결합을 만듭니다. 이러한 유형의 결합을 수소 결합이라고합니다.
런던 분산 상호 작용
런던 분산 힘은 대부분 비극성 분자와 관련이 있습니다. 이는 분자를 형성하는 데 참여하는 원자가 유사한 전기성이라는 것을 의미합니다. 따라서 원자에는 전하가 형성되지 않습니다.
런던 분산의 이유는 분자에서 전자의 무작위 이동 때문입니다. 전자는 언제든지 분자의 어느 쪽이든 발견 될 수 있으며, 그 끝 Δ-를 만듭니다. 이것은 분자 Δ+의 다른 쪽 끝을 만듭니다. 분자에서 의이 쌍극자의 외관은 다른 분자에서도 쌍극자를 유도 할 수 있습니다.
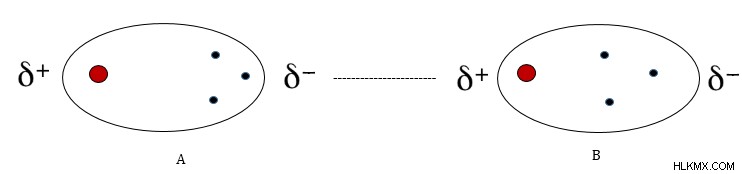
그림 3 :런던 분산 세력의 예
위의 그림은 왼손의 분자의 Δ- 끝이 근처 분자의 전자를 반발하여 분자의 해당 끝에서 약간의 양성을 유도한다는 것을 보여줍니다. 이것은 두 분자의 반대로 하전 된 끝 사이의 매력을 이끌어냅니다. 이러한 유형의 채권을 런던 분산 본드라고합니다. 이것들은 가장 약한 유형의 분자 상호 작용으로 간주되며 일시적 일 수 있습니다. 비극성 용매에서 비극성 분자의 용 매화는 런던 분산 결합의 존재 때문입니다.
반 데르 발스 (Van der Waals)는 어떻게 분자를 함께 유지합니까
위에서 언급 한 반 데르 발스 힘은 이온 성 힘보다 다소 약한 것으로 간주됩니다. 수소 결합은 다른 반 데르 발스 힘보다 훨씬 강한 것으로 간주됩니다. 런던 분산 세력은 가장 약한 유형의 반 데르 발스 세력입니다. 런던 분산 세력은 종종 할로겐 또는 고귀한 가스에 존재합니다. 그들을 함께 유지하는 힘이 강하지 않기 때문에 분자는 자유롭게 떠 다니고 있습니다. 이것은 큰 양을 차지하게 만듭니다.
쌍극자 쌍극자 상호 작용은 런던 분산 힘보다 강하고 종종 액체에 존재합니다. 쌍극자 상호 작용에 의해 함께 유지되는 분자가있는 물질은 극성으로 간주됩니다. 극성 물질은 다른 극성 용매에만 용해 될 수 있습니다.
다음 표는 두 가지 유형의 반 데르 발스 힘을 비교하고 대조합니다.
| Dipole-Dipole 상호 작용 | 런던 분산 세력 |
| 넓은 전기 음성 차이의 원자를 가진 분자 사이에 형성됨 (0.4) | dipoles는 무작위로 움직이는 전자의 비대칭 분포에 의해 분자에서 유도됩니다. |
| 비교적 훨씬 강하고 에너지 | 비교적 약하고 일시적 일 수 있습니다 |
| 극성 물질에 존재합니다 | 비극성 물질에 존재합니다 |
| 물, P- 니트로 페닐, 에틸 알코올 | halogens (cl 2 , f 2 ), 고귀한 가스 (He, Ar) |