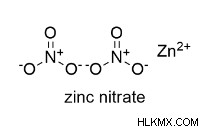
아연 질산염은 염료, 의학 및 기타 화학 제품의 제조에서 촉매로 널리 사용되는 유기 화합물입니다. 그것은 셀록산, 아연 di 질산염 및 질산 아연 육각형과 같은 몇 가지 다른 이름을 가지고 있습니다. 질산 아연의 공식은 Zn (No₃) ₂
입니다
질산 아연은 실온에서 결정질, 흰색 또는 무색 고체입니다. 그것은 물과 알코올에 용해되며 16 진수로 존재합니다 (Zn (no₃) ₂ • 6 h₂o. 아연 질산염은 비 투기성이지만,이 화합물은 다른 가연성 물질의 연소를 가속화하는 힘을 가지고 있습니다. 질산 아연을 가열하면 나트로겐의 독성 산화물이 방출됩니다.
. 아연 질산염 생산
질산 아연은 질산 용액에서 아연의 용해에 의해 제조된다. 희석 및 농축 된 hno₃에 대한 반응은 다음과 같습니다.
Zn + 2 Hno 2 (Dil.) → Zn (NOIT) ₂ (아연 의식) + H₂
4 Zn + 10 Hno₃ (Conc.) → 4 Zn (NOIT) ₂ (질산 아연의 공식) + NH₄NO₃ + 3 HATER
질산 아연이 열 분해 후, 이산화 질소, 산화 아연 및 산소가 형성됩니다.
2 Zn (NOIT) ₂ (아연의 공식) + 열 → 2 ZnO + 4 NO₂ + O₂
아연 질산염의 특성 - Zn (NOIT)
| 아연 질산염에 대한 공식 | zn (No₃) ₂ (아연 II 질산염 공식) |
| 아연 질산염 밀도 | 2.064 g/cm³ (무수) |
| 아연 질산염 분자량 | 189.36 g/mol |
| 아연 질산염 비등점 | 125 ° C (대략) |
| 아연 질산염 용융점 | 110 ° C |
아연 질산염의 화학적 특성
다음은 질산 아연의 화학적 특성입니다.
질산 아연의 열 분해
가열시, 아연 질산염은 분해되어 이산화 질소, 산화 아연 및 산소를 생성합니다. 아래는이 반응의 화학 방정식입니다.
2 Zn (NOIT) ₂ (질산 아연의 화학식) → 2 ZNO + 4 NO₂ + O₂
질산 아연의 탄산나트륨 반응
아연이 탄산나트륨과 반응하면 탄산 아연 및 질산 나트륨이 형성됩니다. 다음은 반응의 화학 방정식입니다.
Zn (NOIT) ₃ (질산 아연의 화학식) + na₂ 코타 → Znco₃ + 2 Nano₃
질산 아연이 암모늄 수산화 암모늄과 반응 할 때
질산 아연의 수산화 암모늄 용액과의 반응은 백색 암모늄 질산염 침전물을 생성합니다. 다음은 반응의 화학 방정식입니다.
Zn (NOIT) ₃ (질산 아연의 화학식) + 2 NH₄OH → Zn (OH) ₂ + 2 NH₄NONO
수산화 암모늄이 첨가되면 질산 암모늄 질산염 침전물이 용해됩니다.
아연 질산 나트륨과 수산화 나트륨 반응
질산 아연이 수산화 나트륨과 반응 할 때, 수산화 아연의 침전물이 수득된다. 다음은 이것에 대한 반응입니다 :
2 NaOH (수성) + Zn (NOIT) ₂ (수성) (아연 II 질산염 공식) → Zn (OH) + 2 Nano₃ (수성) (아연 II 질산염 공식)
상기 반응에서 과도한 양의 수산화 나트륨을 첨가하면, 수산화 아연 침전물이 형성 될 것이다.
. 아연 질산염 구조 - Zn (No₃) ₂

아연 질산염 사용
- 아연 질산염이 조정 폴리머 제조에 사용됩니다.
- 염색 과정에서 모르 드로 사용됩니다.
- 수지 생산에서 촉매로 사용됩니다.
- 아연 질산염은 강력한 산화제로서 몇 가지 응용 프로그램을 가지고 있습니다.
- 액체 비료 및 라텍스 응고제 제조에 사용됩니다.
- 의약품 생산에 사용됩니다.
질산 아연의 건강 위험
아연 질산염 먼지의 흡입은 코와 목구멍 자극을 초래하면서 미량의 양을 삼키면 소화관 부식이 발생할 수 있습니다. 피부에 질산 아연과의 접촉은 자극과 피부 발진으로 이어집니다.
질산 아연이 가열되면 질소의 독성 산화물이 방출 될 수 있습니다. 질산 아연 자체는 가연성이 없지만 다른 가연성 물질과 접촉하면 연소의 강도가 증가하여 때로는 위험 할 수 있습니다.
아연이란 무엇입니까?
아연은 인체의 필수 영양소 역할을하는 요소이며, 이는 신체가 독립적으로 생산할 수 없음을 의미합니다. 따라서식이 요법에 공급해야합니다. 신체의 수많은 과정은 효소 반응, 유전자 발현, 단백질 합성, 면역 기능, DNA 합성, 성장 및 발달 및 상처 치유와 같은 아연이 필요합니다. 아연은 자연적으로 다양한 식물과 동물성 식품에서 발견됩니다. 스낵바, 아침 시리얼 및 자연적으로 아연이없는 베이킹 밀가루와 같은 식품에는 종종 신체가 얻을 수 있도록 합성 형태의 원소가 보충됩니다. 아연은 면역 체계를 향상시키기 때문에 일부 마름모꼴, 비강 스프레이 및 기타 약물에 추가됩니다.
신체에서 아연의 역할
아연은 인체가 여러 가지 방법으로 사용하는 필수 영양소입니다. 철 후, 그것은 신체에서 두 번째로 풍부한 미량 요소이며, 모든 세포에는 어느 정도가 포함되어 있습니다.
면역 기능에서 아연의 역할과는 별도로, DNA 합성, 피부 건강 및 신체의 단백질 생산에 중요합니다. 또한, 세포 성장 및 분열에 중요하기 때문에 신체의 성장과 발달에 중요한 역할을합니다. 냄새와 맛의 감각은 또한 냄새의 주요 효소 중 하나로 아연에 의존하며, 맛 인식은 그것에 달려 있습니다. 아연 결핍은 냄새 나 맛에 대한 인식을 감소시킵니다.
아연의 건강상의 이점
아연은 수많은 건강상의 이점이 있습니다. 따라서식이 요법에 공급되어야합니다. 다음은 다음과 같습니다.
- 아연은 면역계를 높이고 강력하고 건강하게 유지하는 데 도움이됩니다.
- 상처 치유를 가속화합니다. 따라서 병원에서는 특정 궤양, 화상 및 기타 피부 부상의 치료에 사용됩니다.
- 감염, 폐렴 및 연령 관련 황반 변성 (AMD)과 같은 특정 연령 관련 질병의 위험을 줄입니다.
- 아연의 국소 적용은 여드름과 같은 피부 문제를 치료하는 데 도움이됩니다.
- 신체의 특정 염증성 단백질의 수준을 감소시키고 산화 스트레스를 감소시켜 염증을 감소시킵니다. 산화 스트레스는 만성 염증을 일으키며 암, 심장병 및 정신적 감소와 같은 다양한 만성 질환의 발병에있어서 범인입니다.
중요한 포인트
다음은 기억해야 할 몇 가지 중요한 점입니다.
- 아연이 효과적인 루이스 산이기 때문에, 히드 록 실화 및 기타 화학 물질 및 효소 공정 과정에서 귀중한 촉매제이다. 또한 다재다능한 조정 지오메트리를 나타내며, 이는 단백질이 생물학적 반응 동안 입체를 빠르게 변경할 수있게합니다.
- 이산화탄소 및 단백질 소화를 조절하는 데 중요한 두 개의 아연 함유 효소 (카르스복시 펩 티다 제 및 탄산 무수물이 있습니다.
- 이산화탄소는 척추 동물의 혈액에서 탄산 무수물에 의해 중탄산염으로 전환됩니다. 동일한 효소, 탄산 무수물제는 중탄산염을 이산화탄소로 다시 전환시켜 폐를 통해 호기 될 수 있습니다. 이 효소의 경우,이 전환은 표준 혈액 pH 7에서 백만 배 더 걸릴 것입니다. 심지어 혈액 pH 10 이상이 필요할 수도 있습니다.
- 탄수화물 무수물제는 잎 형성, 인돌 아세트산의 합성 및 알코올 발효를위한 식물에 의해 요구됩니다.
- 아연은 인간, 식물 및 미생물이 미량의 양으로 요구됩니다. 그것은 금속성에 저장되고 전달되며, 이는 1000 개 이상의 전사 인자 및 300 개의 효소의 작동에 없어서는 안될 금속성에 필수적이다. 그것은 철 후 인간에서 가장 일반적으로 발견되는 미량 요소이며 모든 효소 그룹에서 발생하는 유일한 금속입니다.
결론
요약하면, 질산 아연은 아세트산의 아연 염입니다. 아연 및 질산염 이온을 함유하는 무기 화합물입니다. 따라서, 그것은 이온 성 화합물로 간주된다. 아연 금속에 질산과 반응하여 제조됩니다. 기타 제제 방법, 아연 공식, 화학 및 물리적 특성, 구조, 응용 및 건강 위험을 포함하여 아연 질산염에 대한 다른 세부 사항 이이 기사에서 논의되었습니다.
자주 묻는 질문
1. 질산 아연은 광범위한 사용을 가지고 있습니까?
A. 질산 아연에는 광범위한 적용이 없지만 실험실에서 조정 폴리머 제조에 사용됩니다. 그것은 제어 된 방식으로 산화 아연으로 분해 될 수 있으며,이 특성은 나노와 같은 다른 종류의 구조를 생성하는 데 사용됩니다. 또한 염색 과정에서 모르 드로 사용됩니다.
2. 아연은 질산염이 산성 또는 기본 화합물입니까? 입니다
A. 질산 아연은 강산과 약한 염기의 염입니다. 이온화에서는 질산염과 아연 이온을 물에 생성합니다. 기본 라디칼 아연 이온의 가수 분해는 약한 염기 아연 수산화 아연 및 수소 이온을 발생시켜 용액을 산성으로 만듭니다.
3. 질산이 아연과 반응 할 수 있습니까?
A. 예, 질산은 아연과 반응 할 수 있습니다. 농축 질산과 아연 및 알루미늄의 반응은 밀도가 높고 다가오는 층이 수동 산화 과정을 통해 형성되기 때문에 발생할 수 없다. 이 층은 추가 부식으로부터 금속을 보호합니다. 또한, 아연의 희석 질산 반응은 발생하지 않습니다.