핵심 개념
이 기사에서, 우리는 다양한 유형의 복합체, 배위 수의 중요성 및 리간드 치환 반응을 포함한 리간드의 화학을 포함하여 복합 이온 및 리간드에 대해 배웁니다.
.화학의 복잡한 이온은 무엇입니까?
무기 화학에서, "복합체"는 하나 이상의 리간드에 대한 좌표 공유 결합을 갖는 중심 금속 이온을 포함하는 구조를 설명한다. 화학자들은“리간드”를 좌표 공유 결합을 형성하기 위해 한 쌍의 전자를 기증 할 수있는 분자로 정의한다. 리간드는 전자 쌍을 기부하기 때문에 루이스베이스로 분류됩니다. 반대로, 중앙 금속 이온은 전자 쌍을 받아들이 기 때문에 루이스 산으로 계산됩니다. 종종 화학적 복합체는 이온 전하를 가지므로 복잡한 이온을 형성합니다.
유형의 복잡한 이온
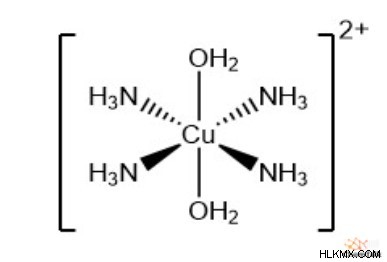
Hexaaqua Complexes
하나의 일반적인 조정 복합체 이온은 6 개의 리간드의 물 분자를 포함한다. 화학자들은“헥사 쿠아 이온”이라는 용어를 사용하여 그러한 복합체를 설명합니다. 코발트 (II), 구리 (II), 철 (II), 철 (III) 및 기타 많은 전이 금속은 헥사 쿠아 복합체에서 중앙 이온으로 작용할 수 있습니다. 중요하게도, 물 분자는 중립 전하를 가지기 때문에 전체 복합 이온의 전하는 중앙 이온의 전하와 동일하게 유지됩니다.
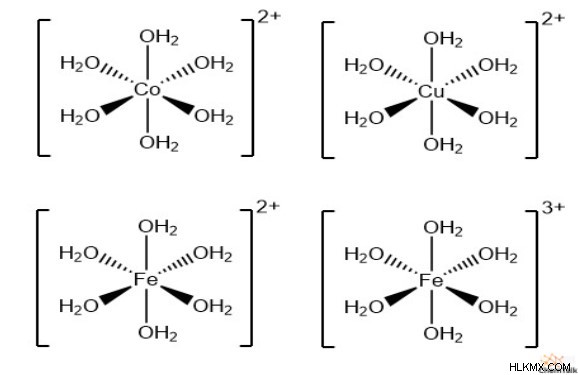
이들 복합체는 금속 양이온이 수용액에 용해 될 때 자발적으로 형성되는 경향이있다. 또한, 좌표 결합은 복합체가 특정 주파수에서 빛을 흡수하여 특정 금속 이온 용액의 색상을 초래합니다.
.
또한, 헥사 카 이온이 물과 반응 할 때, 복합체는 양성자를 방출하여 Arrhenius 산으로 만듭니다. 그렇기 때문에 금속 양이온을 용액에 용해시키는 이유는 결과적으로 pH를 낮추는 것입니다.
[Fe (h 2 o)
동종성 복합체
화학자들은 동종성 복합체를 한 종의 리간드와 단지 복합체로 정의합니다. Hexaaqua 이온 복합체는 물만 포함하기 때문에 동종성 복합체로 계산됩니다. 다른 동종 복합체에는 [CO (NH 3 와 같은 암모니아 리간드 만있는 것들이 포함됩니다. )
이종 복합체
반대로, 화학자들은 이질성 복합체를 적어도 2 개의 별개의 리간드를 갖는 복합체로 정의한다. 이종성 복합체의 예는 [Fe (nh 3 )
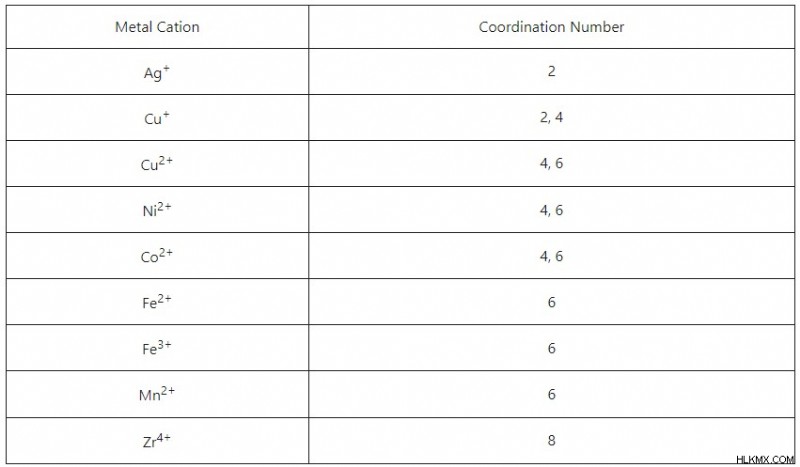
조정 번호 복잡한 이온에서
복잡한 이온을 예측하고 특성화 할 때, 이온의 조정 번호는 명심해야합니다. 화학자들은 중앙 금속 이온에 결합 할 수있는 최대 리간드 수로 "조정 번호"(CN) 또는 "Ligancy"를 정의합니다. 물리적으로, 배위 번호는 리간드가 결합 할 수있는 부위의 수를 나타냅니다. 이온의 조정 번호는 2-8로 다양하며 4와 6이 가장 일반적입니다. 규칙이나 추세는 금속 이온의 배위 수를 확실하게 예측하지 않지만 리간드 멸균 및 금속 원자 반경과 같은 요인은 다소 기여하는 것으로 보입니다.
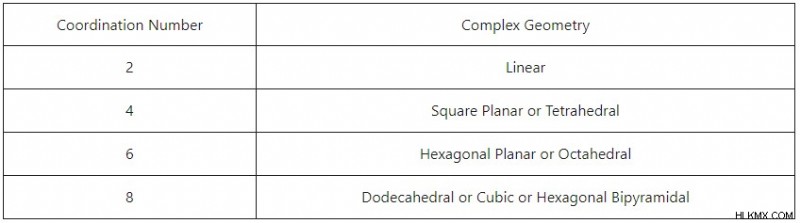
중요하게도, 복잡한 이온의 조정 수는 VSEPR 이론과 유사한 경향에 따라 분자 기하학을 결정한다.
유형의 리간드 복잡한 이온에서
많은 다른 분자는 배위 복합체 이온에서 리간드로서 작용할 수있다. 리간드를 분류하는 한 가지 방법은 전하와 관련이 있습니다.
- 양이온 리간드 :아니오, n 2 h 5 , 1,1,1- 트리 메틸 하이드라 지늄
- 중성 리간드 :H 2 o, nh 3 , CO, o 2 , nh 2 오
- 음이온 성 리간드 :F, CL, BR, I, OH, CN, CH 3 oo
리간드를 분류하는 또 다른 방법은 금속 이온에 결합 할 수있는 리간드 부위의 수를 포함한다. 화학자들은이 속성을 그리스어 용어에서 치아에 대한 리간드의“치열”이라고 부릅니다. 리간드가 이온에서 꺼낼 수있는 최대“물린”수를 결정하기 때문입니다.
가장 간단한 리간드 중 다수는 "단일 분열"으로 계산되며, 이는 금속 이온의 한 부위에만 결합한다는 것을 의미합니다. 예는 다음과 같습니다. F, Cl, H 2 o, nh 3 , CO, NO 및 대부분의 상대적으로 작은 리간드.
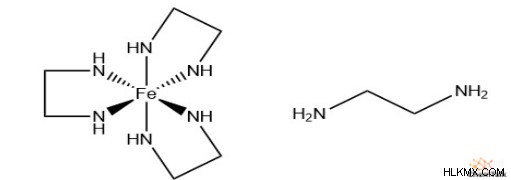
화학자들은 다수의 리간드 부위에 결합 할 수있는 리간드에 대해 "폴리 덴테이트"또는 "킬레이트"라는 용어를 사용한다. 종종, 이들 리간드는 다소 큰 유기 구조를 갖는 경향이있다. 금속 이온은 제 1 결합에 비해 2 차 및 이후 바인딩에서 다분위에 더 높은 친화력을 갖는 경향이있다. 이 "폴리 덴테이트 효과"는 엔트로피에 의해 설명됩니다. 다수의 다수의 결합은 결과적으로 다른 리간드를 대체하여 시스템의 분자가 증가한다.
.
폴리 덴테이트 리간드의 예는 다음과 같습니다.
- BIDEDATE :아세틸 아세토 네이트, 옥살 레이트, 에틸 디아민, 비 피리딘
- 트라이 틀레 테이트 :디 에틸 트리 아민, 테르 피리딘
- 텐트 라덴 테이트 :트리 에틸 테트라 민
- hexadentate :Ethylenediaminetetraacetate (EDTA)
또 다른 중요한 유형의 리간드는“브리징 리간드”라는 이름으로, 이는 여러 금속 이온에 결합 할 수있다. 리간드 브리징은 다수의 중앙 금속을 갖는 복합 이온의 형성을 허용한다. 예는 다음과 같습니다. CO, OH, N 3 및 nh 2 .
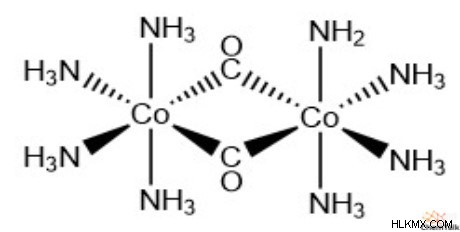
리간드 교환 반응 복잡한 이온에서
상이한 금속 이온 배위 복합체를 합성하기 위해, 화학자들은 리간드 교환 반응을 수행하며, 이는 금속 이온에 결합 된 리간드를 대체한다. 대부분의 복잡한 이온은 복합체가 물에 가용성 금속 양이온 염을 용해시키는 것으로 쉽게 형성되기 때문에 동종 펩티픽 아쿠아 이온으로부터 합성되는 경향이있다.
.
cocl 2 + 6H 2 o <[Co (H 2 o)
이 예에서,이 Hexaaquacobalt (II) 복합체는 거의 모든 코발트 (II) 복합체가 합성 될 수있는 기초를 형성한다.
중요하게도, 임의의 금속 이온 복합체의 형성은 가역적이다. 따라서 Le Chatelier의 원칙은 모든 리간드 교환 반응을 적용합니다. 우리가 헥사 카코 발트 (II) 복합체에서 암모니아의 리간드를 대체하려면 과도한 농축 암모니아를 첨가해야합니다.
[CO (H 2 o)
대신에 우리가 리간드 교환 반응을 수행하는 대신 작은 암모니아 만 첨가하면, 헥사 카 이온이 탈 양성자화됩니다. 이것은 헥사 쿠아 이온의 산성 특성 때문입니다.
[CO (H 2 o)
중요하게도, 이들 탈 양성자 화 된 수산화물 복합체는 종종 상당한 농도에서 침전물을 형성한다.
또한 일부 리간드 교체는 금속 이온의 배위 수를 변경합니다. 우리가 헥사 카카 코발트 (II) 이온을 농축 염산에 넣으면 결과적으로 테트라 코발트 복합체를 형성합니다. 배수에 비해 많은 클로라이드 이온이 추가되어 조정 수가 6에서 4로 변경됩니다.
[CO (H 2 o)
마지막으로, 일부 리간드 교환은 우리가 새로운 리간드의 과잉이있는 경우에도 불완전한 상태로 남아 있습니다. 예를 들어, Hexaaquacopper (ii)는 암모니아를 초과 할 때 Tetraaminediaquacopper (ii) 만 형성합니다.
[CO (H 2 o)