핵심 개념
깁스 프리 에너지 화학 반응의 측면을 예측할 수있는 열역학의 중요한 가치입니다. 이 튜토리얼에서는 Gibbs Free Energy 방정식이 중요한 이유와 관련 문제를 해결하는 방법을 알게됩니다. 우리는 또한 자발적인 반응이 무엇인지 정의 할 것입니다.
다른 기사에서 다루는 주제
- 비열은 무엇입니까?
- 유형의 화학 반응
- 균형 화학 방정식
- 이상적인 가스 법률
- Hess 's Law Requation
- 흡열 대 발열 반응
어휘
- 자발적 반응 : 온도와 같이 시스템에 외부 힘없이 진행되는 반응
- 엔탈피 (H) : 반응 시스템의 전체 열.
- 엔트로피 : 시스템의 장애량을 설명하는 값, 더 많은 엔트로피 값이 더 많은 장애가 있습니다. 예를 들어, 고체는 순서 (낮은 엔트로피)가있는 시스템으로 간주되며 액체 또는 가스는 더 많은 장애 (높은 엔트로피)를 가질 것입니다.
- exergonic : 반응이 자발적 일 때.
- Endergonic : 반응이 비기적 일 때.
자발적 반응 정의
자발적인 반응은 생성물의 형성을 선호하는 반응입니다. 에너지가 감소하고 엔트로피가 증가하는 반응은 자발적입니다. 아래에 정의 된 G 값은 반응이 자발적인지 예측하는 데 도움이됩니다.
자발적인 반응은 진행중인 없이 발생하는 반응이라는 점을 명심해야합니다. 외부 중재 또는 장기간의 에너지 입력. 2H 2 와 같은 일부 자발적 반응 (g) + o 2 (g) -> 2h 2 o (g)는 실제로 반응을 시작하기 위해서는 스파크 (활성화 에너지 유형)가 필요합니다.
깁스 자유 에너지 란 무엇입니까?
Gibbs Free Energy (G)는 반응이 자발적이며, 음의 값을 가진 반응이 자발적이며, 반응이 자발적임을 의미하는 양수 값을 의미하는 값입니다. 이 값은 엔탈피 (H)와 엔트로피의 조합입니다.

깁스 자유 에너지 방정식은 무엇입니까?
깁스 자유 에너지, 엔탈피 및 엔트로피는 모두 간단한 방정식과 관련 될 수 있습니다. 이 공식에서, g, h 및 s는 ∆ (델타)로 표현되어 반응에 대한 이들 값의 변화를 나타낸다. 방정식은 다음과 같습니다.
∆G =∆H - T∆S
이 방정식이 사실을 유지하려면 두 가지 가정을해야합니다.
- 온도는 반응 내내 일정하게 유지됩니다.
- 압력은 반응 내내 일정하게 유지됩니다.
깁스 자유 에너지 문제를 해결하는 방법
공식에 명시된 각 값이 주어지면 깁스 자유 에너지 문제를 해결하는 것은 쉽습니다. 이 반응 방정식부터 시작하겠습니다 :
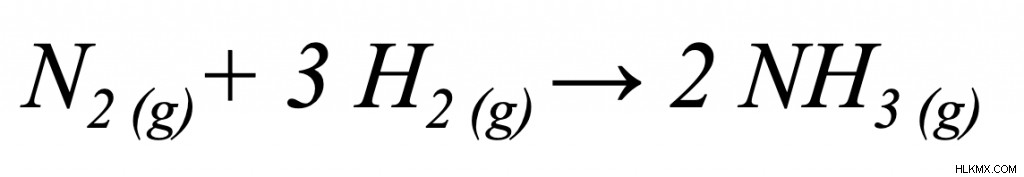
이 반응이 자발적인지 확인할 수 있습니까? 주어진 조건은 다음과 같습니다.
- 온도 :25 ° C
- ∆H :-90 kj/mol
- ∆S :-200 kj/mol k
중요 : 이 방정식이 사실을 유지하려면 온도를 켈빈으로 변환해야합니다. 우리는 켈빈의 가치를 얻기 위해 섭씨의 온도에 273k를 추가하여 섭씨를 켈빈으로 쉽게 변환 할 수 있습니다. 이 경우 273 + 25 =298k. 이제 우리는 온도를 변환 했으므로이 값을 방정식에 꽂는 것입니다!
∆G =∆H - T∆S
∆G = -90 kJ/mol-(298K) (-200 kj/mol k)
∆G =-90 kJ/mol +59600 kj/mol
∆G = 59510 kj/mol
∆G 값은 양수이기 때문에이 반응은 nonponteance 입니다. 또는 endergonic 반응.
추가 예
이제 방정식을 사용하여 ∆G를 찾는 방법을 알았으므로 ∆G와 관련된 더 많은 문제를 시도 할 수 있습니다. 구체적으로, ∆G가 주어지면 방정식의 다른 변수를 해결할 수 있습니다. 다음 문제에서 ∆S를 해결해 봅시다.
주어진 조건은 다음과 같습니다.
- 온도 :25 ° C
- ∆H :28 kj/mol
- ∆G :-4.4 kj/mol
우리는 ∆S를 해결하기 위해 방정식을 재정렬하는 것으로 시작합니다.
∆G =∆H - T∆S
∆G + T∆S =∆H
T∆S =∆H - ∆G
∆S =(∆H - ∆G)/t
이제 ∆S를 해결 했으므로 값을 방정식에 연결할 수 있습니다. 마지막 문제와 마찬가지로, 우리는이 예에서 온도를 다시 298k 인 켈빈으로 변환해야합니다.
∆S =[28 kj/mol-(-4.4 kj/mol)]/298 k
∆S =32.4 kj/mol/298k
∆S =0.11 kj/mol k = 110 j/mol k
추가 읽기
- 화학량 론적 문제 해결
- 어금니 질량 계산
- 수소 결합이란 무엇입니까?
- 고체, 액체 및 가스