이상적인 가스 법칙은 알려지지 않은 가스의 신원을 결정하는 데 사용될 수 있습니다. 알려지지 않은 가스의 압력, 부피 및 온도가 주어지면 가스가 무엇을 구성 할 것인지 결정할 수 있습니다. 이 이상적인 가스 법 예제 문제는이 작업을 수행하는 데 필요한 단계를 보여줍니다.
가스 법률 문제
x 2 의 276.58-g 샘플 (g)는 3.2 atm 및 27 ° C에서 30.0 L입니다. 요소 X는 무엇입니까?
솔루션
이상적인 가스 법칙은 공식으로 표현됩니다
pv =nrt
어디
p =압력
V =볼륨
n =가스 입자의 몰 수
t =켈빈의 절대 온도
그리고
R은 가스 상수입니다.
가스 상수 r은 상수는 일정하지만 압력과 부피를 측정하는 데 사용되는 단위에 따라 다릅니다. 다음은 단위에 따라 R의 몇 가지 값입니다.
r =0.0821 리터 · atm/mol · k
r =8.3145 J/mol · k
r =8.2057 m · atm/mol · k
r =62.3637 l · torr/mol · K 또는 l · mmhg/mol · k
이상적인 가스 법률 문제의 첫 번째 단계는 온도가 절대 온도 스케일인지 확인하는 것입니다. 이것은 많은 학생들에게 일반적인 오류의 원천이며 시작하자마자 그것을 벗어나는 것이 가장 좋습니다.
이 예제의 온도는 27 ° C입니다. 이것을 켈빈으로 변환하려면 공식을 사용하십시오
k =° C + 273
K =27 ° C + 273
K =300 K
이제 우리의 예에 적합한 가스 상수의 값을 선택합시다. 이 예제는 리터와 대기를 사용하므로 우리가 사용해야하는 r의 값은
입니다.r =0.0821 리터 · atm/mol · k
이제 우리는 가스 샘플의 두더지를 찾기 위해 이상적인 가스 법칙을 사용하는 데 필요한 모든 것을 갖추고 있습니다. n 수율에 대한 방정식 해결
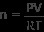
우리의 값을 연결하십시오

n =3.9 몰
우리는 이제 시스템에 알려지지 않은 가스의 3.9 몰이 있다는 것을 알고 있습니다. 우리는 또한이 3.9 몰의 질량이 276.58 그램의 질량을 알고 있습니다. 이제 하나의 가스 무게가 얼마나되는지를 찾으십시오.
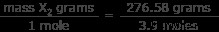
x 2의 몰 질량 =70.9 그램/mol
x 2 우리의 가스가 원소 X의 두 개의 원자의 구조적이거나 퇴비화되어 있음을 의미합니다. 이것은 X의 원자 중량이 x 2 의 절반이된다는 것을 의미합니다. ‘어금니 질량
x =½ (70.9 그램/mol)의 원자 중량
x =35.45 그램/몰의 원자 중량
주기적인 테이블을 보면, 35.45 그램/몰에 가장 가까운 원자 무게의 요소는 염소입니다.
답변
요소 X의 동일성은 염소입니다.
이 유형의 문제로 관찰해야 할 핵심 요점은 절대 온도, 가스 상수 R의 단위 및 미지의 가스의 하나의 원자의 원자 질량입니다. 이상적인 가스 법률 문제는 항상 섭씨 나 화씨와 같은 상대 온도가 아닌 절대 규모 온도에서 항상 작동해야합니다. 가스 상수의 장치는 작업중인 장치와 일치해야합니다. 그렇지 않으면 취소되지 않습니다. 주의를 기울이면 피하기 쉬운 오류입니다. 이 문제는 알 수없는 것과 같은 규정형 가스를 가졌다. 우리 가이 단계를 기억하지 못했다면, 우리는 하나의 가스가 70.9 그램의 질량을 가지고 있다고 생각했을 것입니다. 가스가 갈륨 (69.72 g/mol)이라고 결정했습니다.