갈륨은 원자 번호 31 및 요소 기호 GA를 갖는 화학 요소이며, 이는 전환 후 금속 또는 기본 금속으로 간주됩니다. 갈륨은 낮은 용융점으로 유명하며, 이는 갈륨 숟가락 데모에 적합하고 심지어 손의 순수한 금속을 녹이게합니다. 다음은 발견, 속성, 용도 및 요소의 출처를 포함한 갈륨 사실 모음입니다.
기본 갈륨 사실
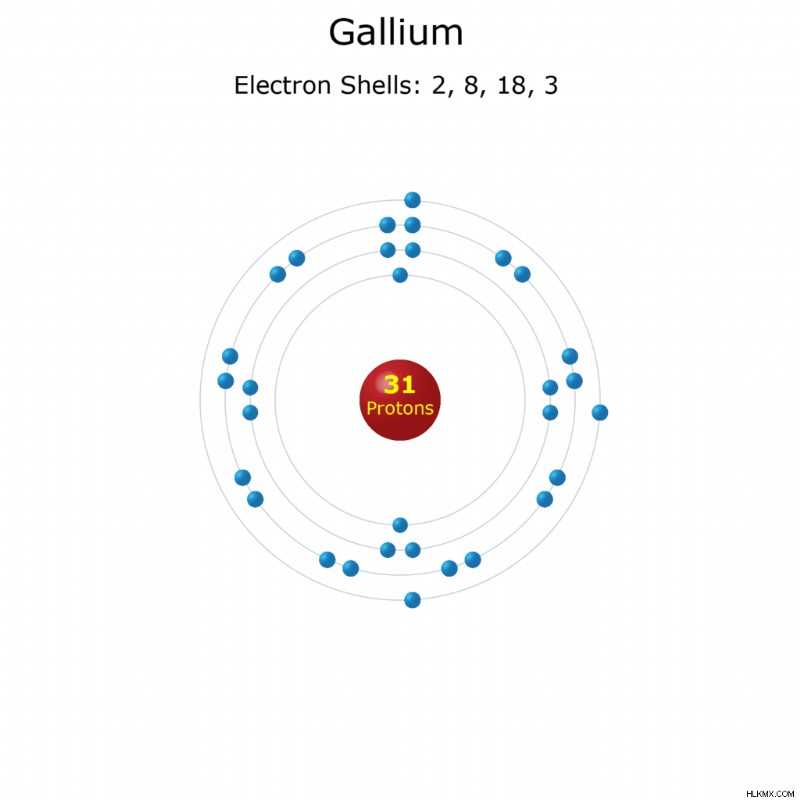
요소 이름 :갈륨
원자 번호 :31
요소 기호 :ga
원자 질량 :69.723 (1)
그룹 :그룹 13 또는 붕소 그룹
기간 :기간 4
블록 :p- 블록
요소 가족 :전환 후 금속 또는 기본 금속
외관 :실온에서 갈륨은 부드럽고 은빛 파란색 고체 금속입니다.
전자 구성 :[ar] 3d 4S 4p
발견 :Lecoq de Boisbaudran 1875 년에 갈륨을 발견하고 분리했습니다. 그러나 Dmitri Mendeleev는 1871 년에 요소의 존재를 예측했습니다. Mendeleev는 제안 된 요소의“Eka-Aluminium”을주기 테이블의 위치에서 지명했습니다. Lecoq de Boisbaudran은 Sphalerite 샘플의 2 개의 바이올렛 스펙트럼 라인에서 갈륨을 확인했습니다. 그는 수산화물의 전기 분해를 사용하여 요소를 분리했습니다.
Word Origin :De Boisbaudran은 요소 31“Gallia”로 선정되어 그의 고향 인 프랑스를 기리기 시작했습니다. 갈리아는 갈리아의 라틴어 이름입니다. 어떤 사람들은 또한 De Boisbaudran의 이름이 단어에 대한 연극이며 프랑스뿐만 아니라 자신의 요소를 지명했다고 말합니다. “르 코크”는“수탉”의 프랑스 단어이며,“수탉은“갤러스”라는 라틴어 단어입니다. 이 요소는 나중에 금속 요소의 -ium 접미사와 함께 Gallium으로 지정되었습니다.
동위 원소 :31 개의 알려진 갈륨 동위 원소는 질량 수 56 내지 86입니다. 2 개의 동위 원소는 안정적이며 자연에서 발생합니다 :갈륨 -69 및 갈륨 -71. 갈륨 -69는 자연 풍부의 60.1%를 차지하고 갈륨 -71은 39.9%를 차지합니다. 다른 모든 동위 원소는 방사성입니다.
사용 :갈륨은 온도계, 특히 독성 수은을 대체하는 데 사용됩니다. 갈륨은 고형 상태 장치와 도프 반도체를 생산하는 데 중요합니다. 갈륨 아르 세나이드는 전기를 일관된 빛으로 변환합니다. 금속은 화려한 거울 코팅을 형성합니다. 갈륨 박동 심장은 수은 박동 하트 데모에 대한 안전한 대안입니다.
생물학적 역할 :갈륨은 인간, 동물 또는 식물 생물학에서 역할을하지 않습니다. 순수 금속은 무독성으로 간주됩니다. 그러나 갈륨은 신체의 철 (III)을 대체합니다. 박테리아, 예 : pseudomonas , 갈륨의 흡수는 호흡을 방해하고 세포 사멸을 초래할 수있다. 인간 의학에서 갈륨은 염증을 추적하고 종양을 표시하는 데 사용됩니다. 이 요소는 항암 특성, 특히 비호 지킨의 림프종 및 요로 암에 대한 특성을 가지고 있습니다. 아민-페놀 갈륨 화합물은 클로로퀸에 내성이있는 것들을 포함하여 말라리아 기생충에 독성이 있습니다.
출처 :갈륨의 주요 상업 공급원은 보크 사이트 광석입니다. 갈륨 생산은 알루미늄 가공의 부산물입니다. 소량의 갈륨은 Sphalerite, 다른 황화물 광석 및 일부 유형의 석탄에서 추출됩니다. 분리 갈륨은 수산화 칼륨 용액에서 수산화물의 전기 분해에 의해 발생합니다.
물리적 데이터
밀도 :5.91 g/cm
용융점 :302.9146 K (29.7646 ° C, 85.5763 ° F)
끓는점 :2673 K (2400 ° C, 4352 ° F)
20ºC의 상태 : 단단한
퓨전 열 :5.59 kj/mol
기화 열 :256 kj/mol
어금니 열 용량 :25.86 J/(mol · k)
자기 순서 :diamagnetic
결정 구조 :orthorombic
Mohs 경도 :1.5
원자 데이터
원자 반경 :135 pm (경험적)
공유 반경 :122 ± 3 pm
van der waals 반경 :187 pm
전기 음성 :1.81 (Pauling Scale)
1 차 이온화 에너지 :578.8 kj/mol
2 차 이온화 에너지 :1979.3 kj/mol
3 번째 이온화 에너지 :2963 kj/mol
산화 상태 :-5, -4, -2, -1, +1, +2, +3
10 갈륨 사실

- 원소 갈륨은 본질적으로 자유롭지 않습니다. 그러나 제련은 금속을 쉽게 방출합니다.
- 당신은 손바닥에 갈륨을 녹일 수 있거나 뜨거운 음료로 녹을 숟가락을 만들 수 있습니다. 모든 요소 중
- 갈륨은 액체로서 가장 높은 온도 범위를 갖습니다. 갈륨의 용융점과 끓는점 사이에는 2373 ° C가 있습니다!
- 대부분의 물질과 달리 갈륨은 얼어 붙을 때 확장됩니다. 이 동작을 나타내는 또 다른 자료는 물입니다. 갈륨은 유리 나 금속 용기에 저장되어서는 안됩니다. 요소가 고형화 될 때 산산이 부서 질 수 있습니다.
- gallium arsenide는 매우 밝은 파란색 LED를 생산하는 데 사용됩니다.
- 액체 갈륨은 요소가 많은 표면을 짜기 때문에 뛰어난 거울을 형성합니다. 갈륨 젖은 유리, 도자기, 심지어 인간의 피부.
- "갈륨 박동 심장"은 "수은 박동 심장"화학 시연을 안전하게 대체합니다.
- 갈륨의 95% 이상이 반도체 산업에서 사용됩니다.
- 순수한 갈륨은 미네랄 산에 대한 공격에 저항합니다. 표면에 형성되는 산화물 층은 내부를 보호합니다.
- 다른 금속에 첨가 될 때, 갈륨은 낮은 멜팅 합금을 형성합니다.
참조
- Greenwood, N.N.; Earnshaw, A. (1997). 요소의 화학 (제 2 판). 옥스포드 :Butterworth-Heinemann. ISBN 0-7506-3365-4.
- Lehto, R. S. (1968). "아연". Clifford A. Hampel에서. 화학 요소의 백과 사전 . 뉴욕 :Reinhold Book Corporation. pp. 822–830. ISBN 0-442-15598-0.
- Lide, David R., ed. (2006) 화학 및 물리학 핸드북 (87th ed.). BOCA RATON, Florida :CRC Press, Taylor &Francis Group. ISBN 0-8493-0487-3.
- Nordberg, Gunnar F.; 파울러, 브루스 A.; Nordberg, Monica (2014). 금속의 독성학 핸드북 (제 4 판). 학업 언론. 788–90 쪽. ISBN 978-0-12-397339-9.