핵심 개념 - 반응물 제한 :
이 튜토리얼에서는 제한적인 시약이 무엇인지, 제한 반응물을 찾는 방법을 배우고 몇 가지 예제 문제를 보게됩니다.
제한 시약 란 무엇입니까?
제한 반응물은 화학 반응에서 완전히 소비되는 시약 (화합물 또는 요소)이다. 반응물 제한은 또한 남은 것이 없기 때문에 반응이 계속되는 것을 방지하는 것입니다. 제한 반응물은 또한 제한 시약 또는 제한 제로 지칭 될 수있다. 소비되지 않은 반응물을 과도한 반응물이라고합니다.
예를 들어, 빵 두 조각, 토마토 조각 및 고기 조각이있는 햄버거를 모 으려고하는 경우 고려하십시오. 반응은
입니다1 토마토 + 1 고기 + 2 빵 -> 1 버거
3 개의 토마토 조각, 고기 2 조각 및 빵 6 개가 있습니다.

샌드위치를 만들기 위해 결합되면, 첫 번째 성분은 고기입니다. 당신은 두 개의 햄버거를 만들기에 충분한 고기를 가지고 있지만 3 개의 햄버거를 만들기에 충분한 토마토와 빵이 있으므로 고기는 제한적인 시약입니다. 고기는 최초의 재료입니다. 빵과 토마토는 과도하여 과도한 반응물이라고합니다. 화학 반응에 대해서도 같은 아이디어가 사실입니다.
방정식의 균형을 완벽하게 균형을 맞추고 싶은 분자의 수를 항상 추가 할 수는 없기 때문에 제한 시약을 찾을 수 있어야합니다. 종종 한 번의 시약이 더 저렴하고 더 비싼 시약이 완전히 사용되도록하기 때문에 초과를 초과 할 수 있습니다.
제한 반응물로부터, 이론적 수율도 계산할 수있다. 이론적 수율은 제한 시약으로부터 형성 될 수있는 최대 제품의 양이다. 그러나 반응의 실제 수율은 거의 항상 이론적 수율보다 적습니다. 그렇기 때문에 백분율 수율이 이론적 수율을 실제 수율과 비교하기 위해 계산되는 이유입니다.
제한 반응물을 찾는 방법
제한 시약을 찾는 방법에는 여러 가지가 있습니다. 한 가지 열쇠는 항상 균형 잡힌 화학 반응으로 시작하는 것입니다. 무게가 아닌 두더지 양 (즉, 그램)을 항상 비교하는 것이 필수적입니다. 두더지만이 제한 시약을 결정하는 데 작용합니다.
방법 1- 비교 제품 생산
이 방법을 통해 우리는 암모니아를 만들기 위해 질소와 수소 사이의 반응을 고려할 것입니다.
n 2 + h 2 -> nh 3
- 균형 잡힌 화학 방정식으로 시작하십시오
n 2 + 3 h 2 -> 2 nh 3
2. 화학량 론을 사용하여 각 시약의 두더지로 주어진 양을 변환하십시오.

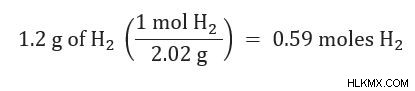
3. 각 시약에 대해, 얼마나 많은 몰의 생성물이 생산 될 것인지 계산하십시오.


4. 제품의 최소량을 생산하는 시약은 제한적인 시약입니다.
0.72 mol nH 3 (n < 2 에서 )> 0.39 mol nH 3 (H 2 에서 )
따라서 h 2 제한 시약입니다
방법 2- 대피 시약 이용 가능
n 2 + h 2 -> nh 3
- 균형 잡힌 화학 방정식으로 시작하십시오
1 n 2 + 3 h 2 -> 2 nh 3
2. 주어진 양 (예 :그램)의 양을 각 시약의 두더지로 변환합니다.


3. 두더지 비율을 사용하여 제품 A가 필요한 제품 B의 양으로 변환하십시오.

4. B의 계산 된 양이 실제 B의 실제 양보다 높으면 B가 제한 반응물임을 의미합니다. 계산 된 금액이 실제 금액보다 낮은 경우 B보다 적은 양보다 제한된 시약이 아닙니다.
B =1.08 몰 h 2 의 계산 된 양
B =0.59 Mole H 2 의 실제 양
1.08 MOLE> 0.59 MOLE H 2 이기 때문입니다 우리는 h 2 을 알고 있습니다 이 문제에서 암모니아를 생산할 때 제한적인 시약입니다.
모든 방법은 화학 방정식의 균형을 유지 한 다음 모든 금액을 두더지로 변환하는 것으로 시작합니다. 그런 다음 형성된 제품의 두더지 비율 또는 필요한 시약의 양을 비교하십시오.
제한 시약을 찾는 방법의 문제
문제 :0.4 g의 h 2 가 있습니다 및 1.8g의 o 2 물을 만들기 위해. 물을 생산할 때 제한 반응물은 무엇입니까?
해결책 :
화학 반응의 균형을 유지하여 시작하십시오.
2 h 2 + 1 o 2 -> 2 h 2 o
그램으로 제공된 금액을 그램으로 변환하십시오.

각 시약에 의해 생산 된 제품의 양을 계산하십시오 

적은 양의 제품을 확인하기 위해 생산 된 제품의 양을 비교하십시오.
상기 결과는 산소 (O 2 임을 보여줍니다 ) 더 많은 물을 생성합니다 (h 2 o) 수소보다 (H 2 ). 따라서 수소는 제한 시약입니다.







