전자 궤도 란 무엇입니까?
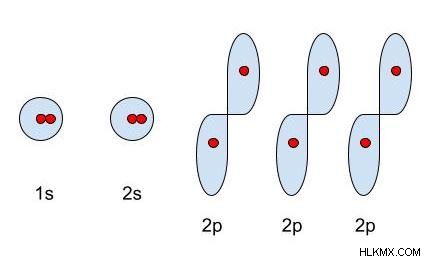
전자 궤도 특정 전자가 존재하는 원자의 핵 주위의 3 차원 영역입니다. 각 궤도는 두 개의 전자를 담을 수 있습니다. 그것들은 원자 궤도라고도합니다. 원자 궤도는 원자가 가지고있는 전자의 수에 따라 다른 모양으로 제공됩니다. 우리는 궤도, p 궤도, d 궤도 및 궤도에 대해 배울 것입니다. 우리는 또한 그들의 궤도 모양을 배울 것입니다.
정확한 정의 궤도의 경우, 확률에 기초하여 원자에서 전자의 위치를 설명하는 수학적 함수이다. "원자 궤도"는 일반적으로 해당 궤도의 수학적 함수에 기초하여 전자가 존재할 수있는 공간의 영역을 나타냅니다.
퇴화 궤도는 동일한 주 에너지 수준의 궤도이며 다른 방향을 갖는 SUBLEVEL입니다. 예를 들어, 3D 평면에서 D- 궤도의 5 방향은 퇴화 궤도입니다.
양자 번호의 기본 검토
양자 번호에 대한 자세한 내용은 양자 번호 기사를 확인하십시오! 에너지 수준, 모양, 방향 및 궤도의 전자 스핀을 알려주는 4 가지 양자 수가 있습니다.
- 주요 양자 수 ( n ) :전자의 주요 에너지 수준을 나타냅니다. 주요 양자 수가 높을수록 에너지 수준이 높아서 핵과 특정 전자 사이의 거리가 더 많을수록. .
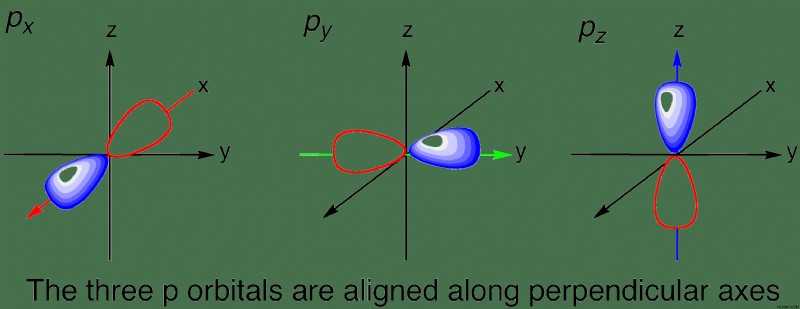
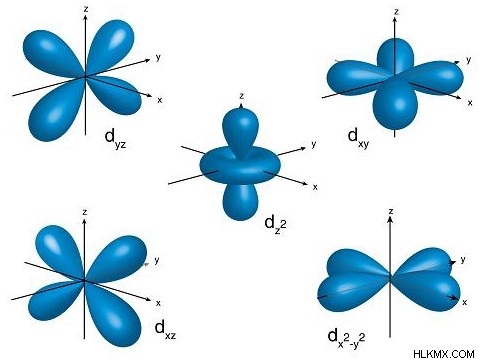
- 각 운동량 양자 수 ( l ) :궤도의 모양을 나타냅니다. l 의 다른 값 전자 궤도의 특정 모양에 해당합니다. 이것은 나중에 더 자세히 논의 될 것입니다.
- 자기 양자 수 ( m ) :핵 주위의 궤도의 방향을 나타냅니다. 다른 궤도는 다른 모양을 가지기 때문에 3D 코디네이션 평면 주위에서 많은 방향을 회전시킬 수 있습니다.
- 스핀 양자 수 :궤도의 전자가 회전하는 방향을 나타냅니다. 스핀 양자 수의 두 가지 가능한 값은 -1/2 및 +1/2입니다. 궤도 당 최대 2 개의 전자가 있으며, 둘 다 궤도에 존재하면 반대 방향을 회전시켜야합니다 (반대 스핀 양자 번호가 있음) .
각 운동량 양자 수 및 궤도 형태
각 운동량 양자 수는 0에서 ( n 의 정수 값을 갖습니다. -1). 따라서 주요 양자 수 ( n ) =4, 각 운동량 양자 수는 0, 1, 2 및 3입니다.
각 각도 운동량 양자 수는 문자를 나타내며, 이는 궤도의 특정 모양에 해당합니다. 보시다시피, 주요 양자 수가 높을수록 각 운동량 양자 수가 높을수록 궤도 모양이 더 복잡해집니다. 대부분, 당신은 궤도, p 궤도, 궤도 및 궤도를 알아야합니다 - f 궤도 후에 모양이 너무 복잡해집니다.
.| Principal Quantum # ( n ) | angular momentum Quantum # ( l ) | 편지 | 궤도 모양 다이어그램 |
| 1 | 0 | s | 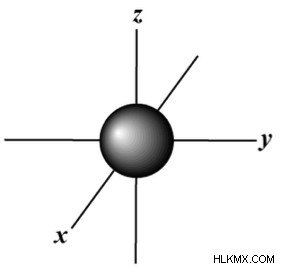 |
| 2 | 1 | p | 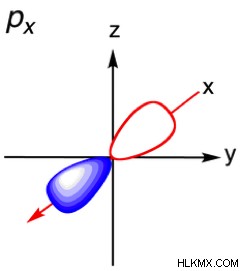 |
| 3 | 2 | d | 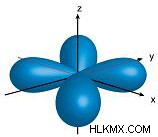 |
| 4 | 3 | f |  |