산베이스 중화 반응이란 무엇입니까?
산베이스 중화 반응은 산이 염기와 반응하여 물과 소금을 생성 할 때입니다.
산으로부터의 양성자 (h)는 염기에서 수산화물 (OH)과 결합하여 물을 만들기 (H 2 영형). 형성된 소금은 산과 염기에서 나옵니다.

이러한 유형의 반응은 산과 염기를 중화하기 때문에 중화 반응이라고합니다. 강산 및 강한 염기가 완전히 반응하면 (각각의 동일한 두더지가 있음), 결과 용액의 pH는 7 (중성)을 가질 것이다.
중화 반응은 또한 이중 변위 반응의 한 유형입니다.
중화 반응의 산물은 무엇입니까?
중화 반응의 생성물은 항상 물이 될 것입니다 (H 2 o) 소금. 형성된 염은 산과 사용 된 염기에 따라 다릅니다. 소금은 용액에 용해되어 용해되거나 용액에서 불용성 및 침전물 일 수 있습니다.
강산 및 강한 염기 중화 반응
강산과 강한 염기의 완전한 중화는 동일한 두더지의 강산 및 강한 염기가있을 때 발생합니다. 결과는 pH가 7 인 수성 용액입니다.
강한 산과 강한 염기는 많지 않습니다. 아래는 그들 모두의 테이블입니다.
| 강산 | 강한베이스 |
| hcl | lioh |
| hbr | naoh |
| hi | koh |
| hno 3 | ca (OH) 2 |
| h 2 그래서 4 | rboh |
| hclo 3 | sr (OH) 2 |
| hclo 4 | csoh |
| | ba (OH) 2 |
약산 또는 약한 염기를 사용한 중화
약산 또는 약한 염기와의 반응은 일반적으로 pH 7의 결과를 초래하지 않습니다. 물과 소금은 여전히 생성됩니다.
반응이 약산과 강한 염기를 포함한다면, 생성 된 pH는 약간 기본적이다 (pH> 7).
중화 반응이 강산 및 약한 염기를 포함 할 때, 생성 된 pH는 약간 산성이 될 것이다 (pH <7).
산과 염기가 모두 약하면 최종 pH는 pk a 에 의존합니다. 산과 염기의. pH는 산성, 기본 또는 중성 일 수 있습니다. 이러한 반응은 종종 약산 및 약한 염기의 제한된 해리로 인해 완료까지 진행되지 않습니다.
| 산성 유형? | 기본 유형? | 중화 pH |
| 강산 | 강한베이스 | pH =7 |
| 강산 | 약한베이스 | pH <7 (산성) |
| 약산 | 강한베이스 | pH> 7 (기본) |
| 약산 | 약한베이스 | 는 pk a 에 따라 다릅니다 및 pk b |
예제 문제
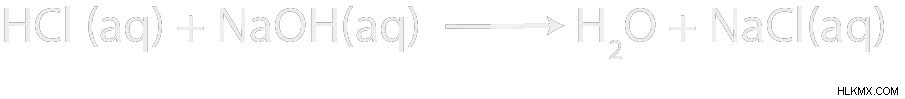
물에 HCL과 NAOH의 반응이 있다고 가정 해 봅시다. 제품은 무엇입니까? 이것은 어떤 종류의 반응입니까? 그리고 순 이온 방정식은 무엇입니까?
HCL은 강한 산입니다. Naoh는 강력한 기반입니다. 산과 염기가 모두 존재하기 때문에 산성 염기 중화 반응이 있음을 알고 있습니다.
중화 반응의 생성물은 항상 물과 소금 일 것입니다. 이 경우 소금은 NaCl입니다. 나트륨 이온은 강한 염기에서 나오고 염화물 이온은 강산에서 나옵니다.
다음으로 순 이온 방정식 (NIE)을 쓰고 싶습니다. 우리의 반응에있는 몇몇 종은 수성이므로 우리는 방정식을 단순화 할 수 있어야합니다. 우리는 방정식의 양쪽에 나타나는 모든 관중 이온을 제거함으로써 순 이온 방정식을 얻습니다. 이 경우 Cl and Na.
입니다 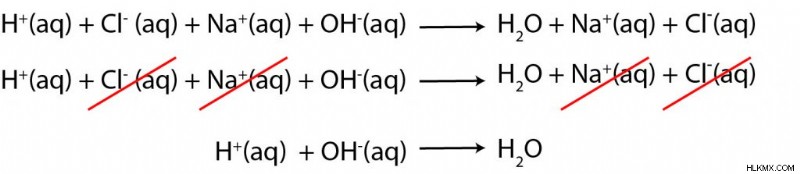
그 결과 우리는 바닥으로부터 수산화물 (OH)과의 산 반응으로부터 물을 형성하기 위해 양성자 (H)를 가지고있다!
. 실생활 사례
요리는 일반적으로 산성베이스 중화 반응을 사용합니다! 예를 들어, 케이크를 굽을 때는 종종 중탄산염 (베이킹 소다)을 성분으로 첨가합니다. 베이킹 소다는 기초입니다. 일부 성분에는 산이 있습니다! 일반적인 것은 레몬 주스, 식초 또는 크림입니다. 요리 중에 산과 염기가 반응 할 때는 물 (모든 중화 반응과 마찬가지로)과 이산화탄소를 생성합니다. 이산화탄소 거품은 케이크 (및 기타 구운 제품)가 푹신하고 가벼운 것입니다!
실험을하려면 집에서 시도 할 수 있습니다. Science is Fun 이이 실험을 확인하십시오!

기타 관련 관심 기사
- 산 기본 이론
- 산 기본 화학
- 산 및 염기의 특성











