게이 lussac의 법칙은 무엇입니까?
Gay-Lussac의 법칙은 가스의 압력이 질량과 부피가 일정하게 유지 될 때 온도에 따라 직접적으로 변하는 가스 법입니다. 온도가 증가함에 따라 압력도 증가합니다. 개념은 아래에 그래픽으로 표시됩니다.
이 현상은 온도가 증가함에 따라 가스 분자의 운동 에너지가 증가하기 때문에 발생합니다. 증가 된 에너지는 분자가 용기의 벽과 충돌하여 힘이 더 높은 것을 의미합니다. 이는 더 높은 압력을 의미합니다.
게이 lussac의 법칙은 때때로 아몬턴의 법칙이라고도합니다. Amonton은 측정 압력이 현재 온도에 대한 판독 인 온도계를 만들어 동일한 법칙을 입증했습니다. Gay-Lussac은 법을보다 정확하게 입증 했으므로 그의 이름으로 더 자주 불려집니다.
게이 Lussac의 법률 공식
Gay-Lussac의 법칙은 부피와 질량/두더지가 일정하게 유지 될 때 압력과 온도가 상수와 관련이있는 공식을 제공합니다. 즉,
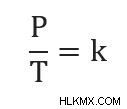
우리는 또한 두 가지 지점에서 압력과 온도를 둘 다 동일한 상수 값과 같기 때문에 관련 될 수 있습니다. 즉,
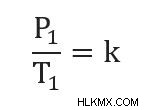
그리고
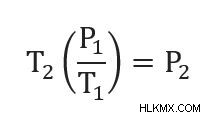
따라서
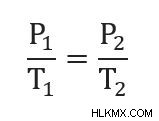
이 공식은 다양한 형식으로 작성 될 수 있습니다. 예를 들어, 변수를 재 배열하여
를 얻을 수 있습니다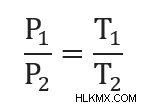
이 방정식의 k는 이상적인 가스 법칙을 재정렬하여 해결할 수 있습니다.
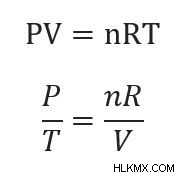
우리는 부피 (v)와 두더지 (N)를 일정하게 유지하고 있습니다. R은 항상 일정합니다. 따라서 바닥 방정식의 전체 오른쪽은 상수입니다.
Gay-Lussac의 법률 실생활 예
겨울에는 온도가 떨어지면 차에서 타이어 압력 경보가 낮다는 것을 알 수 있습니다. 이 현상은 우리가 게이 lussac의 법칙에서 볼 수있는 관계 때문에 발생합니다. 따라서 온도가 떨어지면 타이어의 압력량은 직접 비례하기 때문에 떨어집니다. 그러나 총 부피와 내부의 총 가스 질량은 모두 동일하게 유지됩니다. (온도가 크면 타이어의 부피가 변하지만 온도가 작은 경우에는 상대적으로 동일하게 유지됩니다)
프로판 탱크도 마찬가지입니다. 탱크는 외부의 온도에 따라 (탱크를 그릴을 사용하지 않는 한) 압력이 낮거나 더 높은 압력을 읽을 수 있습니다. 온도가 증가함에 따라 탱크의 압력 게이지가 더 높아집니다.
온도가 감소하기 때문에 압력 감소의 시각을 위해서는 붕괴를 보거나 시험해 볼 수 있습니다! 이 실험은 게이 lussac의 법칙을 완벽하게 표현하는 것이 아니라 온도로 인한 압력 변화의 좋은 예입니다. Gay Lussac의 실험에서 그는 체적이있는 견고한 용기를 가지고있었습니다.
Gay-Lussac의 법률 예제 문제
문제 :20C에서 2.00 ATM의 압력이있는 에어로졸 용기를 폐기하려고합니다. 컨테이너가 배치되면 110C의 온도로 증가 할 수 있습니다. 이 온도에서 압력은 무엇입니까?
작업 솔루션 :
먼저, 우리는 우리가 가진 변수를 식별해야합니다. P1 =2.00 ATM, T1 =20C 또는 293K, T2 =110C 또는 383K를 알고 있습니다. 우리는 p 2 를 해결하려고 노력하고 있습니다 .
게이-루이스의 법칙에 대한 방정식은 다음과 같습니다.
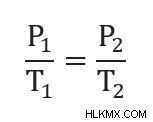
p 2 를 해결하기 위해 재 배열 할 수 있습니다 .
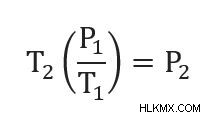
이제 우리는 값을 연결하고 해결합니다.
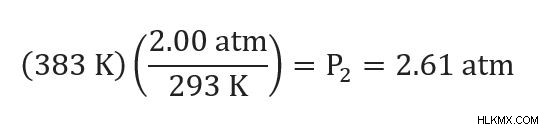
문제 :자동차 타이어는 2.24 ATM을 읽고 외부 온도는 80F입니다. 외부 온도가 0F 인 경우 타이어 압력은 무엇입니까? (타이어가 평평 해지면 변하지 않는다고 가정합니다)
작업 솔루션 :
우리는 타이어를보고 있으므로 두더지와 부피의 수가 일정하므로 게이 -luccass의 법칙을 사용할 수 있습니다.
우리의 p 1 =2.24 atm 및 t 1 =80F 또는 300K. 우리는 또한 t2 =0f 또는 255 K를 알고 있습니다. p 2 를 해결해야합니다. .
위의 문제에서 우리는 재 배열 된 방정식을 가지고 있습니다. (방정식을 재정렬하는 방법을 기억하지 못하면 이전 문제에서 해결되었습니다)
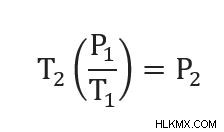
그런 다음 우리는 우리가 알고있는 숫자를 연결하고 대답을 계산할 수 있습니다.
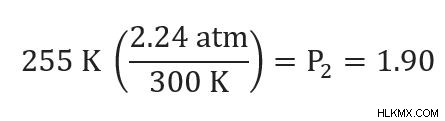
새로운 타이어 압력은 1.90 ATM입니다. 이전 타이어의 2.24 atm보다 현저히 낮습니다!
누가 게이 -Lussac인가?
조셉 루이 게이-루이스 (Joseph Louis Gay-Lussac)는 1778 년부터 1850 년까지 살았던 프랑스 화학자였으며 1800 년대 초 유명한 게이 루이스의 법을 발견하고 나누었습니다. 위에서 설명한 법 외에도 그는 많은 분석 화학 기술을 개발하고 붕소를 발견했습니다. 그는 칼슘과 칼륨을 포함한 몇 가지 다른 요소를 발견 한 Humphry Davy와 경쟁을 가졌습니다.
재미있는 사실! 높은 고도에서 지구의 자기장을 측정하기 위해 Gay-Lussac은 약 50 년 동안 가장 높은 풍선 비행의 세계 기록을 세웠습니다. 그는 약 7,000 미터 또는 23,000 피트의 높이에 도달했습니다.
기타 가스 법률
- 이상적인 가스 법률
- 보일 법
- 찰리 법칙
- Avogadro의 법칙
- 달튼의 법률
- 결합 된 가스 법률







