주요 차이 - 자발적 대 비 회전 반응
자발적 및 비정상적인 반응은 환경에서 발생할 수있는 두 가지 유형의 화학 반응입니다. 자발적 반응은 주어진 조건에 따라 자체적으로 발생합니다. 그러나, 비 단방향 반응을 위해 에너지가 제공되어야한다. 깁스 자유 에너지의 변화는 자발적인 반응에 대해 부정적입니다. 따라서 이러한 반응은 열 형태로 주변에 에너지를 방출합니다. 비교적 반응에서 깁스 자유 에너지의 변화는 긍정적입니다. 그들은 환경에서 에너지를 흡수합니다. 그 설명에서, 자발적 반응은 외계인이고, 비방 반응은 엔도 론적이다. 주요 차이 자발적 반응과 비 단호한 반응 사이에서 자발적 반응은 시스템에서 자유 에너지를 방출하여 더 안정적으로 만들어주는 반면, 비 단호한 반응은 시스템의 총 에너지를 증가시킵니다 .
주요 영역을 다루었습니다
1. 자발적 반응이란 무엇입니까
- 정의, 열역학, 예
2. 비교적 반응은 무엇입니까
- 정의, 열역학, 예
3. 자발적 반응과 비 단호한 반응의 유사점은 무엇입니까
- 일반적인 기능의 개요
4. 자발적 반응과 비 회전 반응의 차이점은 무엇입니까
- 주요 차이점 비교
핵심 용어 :엔도 닉 반응, 엔트로피, 엑서 닉 반응, 깁스 자유 에너지, 자발적 반응, 자발적 반응

자발적 반응이란 무엇인가
자발적 반응은 외부 힘에 의해 구동되지 않고 발생하는 화학 반응을 나타냅니다. 화학 반응의 두 원동력은 엔탈피와 엔트로피입니다. 엔탈피는 압력의 산물과 시스템의 부피에 추가 된 내부 에너지의 합인 시스템의 열역학적 특성입니다. 엔트로피는 단위 온도 당 시스템의 열 에너지를 설명하는 다른 열역학적 특성입니다. 분자의 무작위성과 장애를 설명합니다. 화학 반응이 발생하면 엔탈피가 감소하고 시스템의 엔트로피가 증가하면 유리한 반응으로 간주됩니다. 자발적 반응이 위의 두 가지 조건을 충족시키기 때문에 내부 개입없이 발생합니다.

그림 1 :목재 연소
연소는 자발적인 반응의 예입니다. 화재의 제품은 부분적으로 이산화탄소와 수증기의 두 가스로 구성됩니다. 연소는 열을 생성합니다. 따라서, 그것은 외계 반응입니다. 열은 시스템의 엔트로피를 증가시킵니다. 그러나 연소 생성물의 엔트로피에는 엔트로피가 감소합니다.
비대 반응이란 무엇입니까
자발적 반응은 진행하기 위해 에너지 입력이 필요한 화학 반응을 나타냅니다. 비 간식 반응에서, 엔탈피와 엔트로피는 반응물을 선호합니다. 따라서 반응물은 제품보다 더 안정적입니다. 그 설명에서, 화학 반응은 엔도 닉이며 열을 흡수합니다. 엔트로피도 감소합니다. 비 회전 반응에서 시간이 지남에 따라 깁스 자유 에너지의 변화는 그림 2에 나와 있습니다.
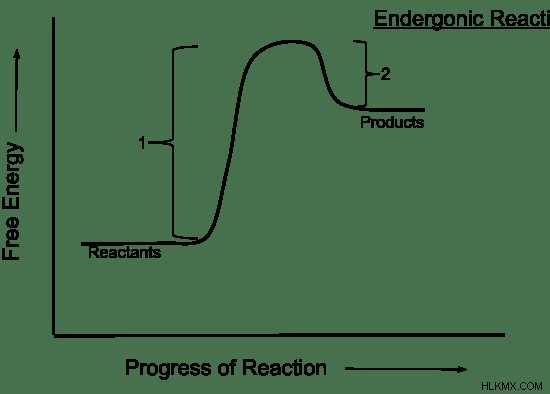
그림 2 :깁스 자유 에너지/시간의 변화
대기 질소와 산소 사이의 반응은 자발적 반응의 예입니다. 일산화 질소를 형성합니다. 정상적인 대기압과 온도 에서이 반응은 바람직하지 않습니다. 이는 화학 반응의 반응물, 즉 질소 및 산소 가스가 생성물보다 더 안정적임을 의미합니다 :질소 일산화 질소. 그러나 번개와 같은 매우 높은 온도 에서이 반응은 유리합니다.
자발적 반응과 비 회전 반응 사이의 유사성
- 자발적 및 비전문 반응은 환경에서 발생합니다.
- 자발적 반응과 비 단호한 반응은 정의 된 경계가있는 시스템에서 발생합니다.
- 자발적 및 비 회전 반응은 열역학의 세 가지 법칙에 순종합니다.
자발적 반응과 비 회전 반응의 차이
정의
자발적 반응 : 자발적 반응은 외부 힘에 의해 구동되지 않고 발생하는 화학 반응을 나타냅니다.
자발적 반응 : 비교 반응은 진행하기 위해 에너지 입력이 필요한 화학 반응을 나타냅니다.
유리한/불리한
자발적 반응 : 자발적 반응은 유리합니다.
자발적 반응 : 비교적 반응은 바람직하지 않습니다.
에너지 입력
자발적 반응 : 자발적인 반응은 일련의 조건에서 에너지 입력이 진행되도록 필요하지 않습니다.
자발적 반응 : 비교적 반응은 진행하기 위해 에너지 입력이 필요합니다.
깁스 자유 에너지의 변화
자발적 반응 : 자발적 반응에서 깁스 자유 에너지의 변화는 음성입니다 (ΔG ° <0).
자발적 반응 : 비 단호한 반응에서 깁스 자유 에너지의 변화는 양성입니다 (ΔG ° > 0).
시스템의 총 에너지
자발적 반응 : 자발적 반응은 시스템에서 자유 에너지를 방출하여 더 안정적으로 만듭니다.
자발적 반응 : 비 단호 반응은 시스템의 총 에너지를 증가시킵니다.
제품의 총 에너지
자발적 반응 : 자발적 반응의 생성물의 총 에너지는 반응물의 총 에너지보다 적습니다.
자발적 반응 : 비전자 반응의 생성물의 총 에너지는 반응물의 총 에너지보다 높습니다.
엔탈피
자발적 반응 : 자발적 반응은 부정적인 엔탈피를 가지고 있습니다.
자발적 반응 : 비교적 반응은 긍정적 인 엔탈피를 가지고 있습니다.
exergonic/endergonic 반응
자발적 반응 : 자발적인 반응은 외생 적 반응입니다.
자발적 반응 : 비전자의 암송은 endergonic 반응입니다.
엔트로피
자발적 반응 : 자발적 반응은 엔트로피를 증가시킵니다.
자발적 반응 : 비전자 반응은 엔트로피를 감소시킵니다.
반응 속도
자발적 반응 : 자발적 반응은 빠르게 발생합니다.
자발적 반응 : 비 단호한 반응은 덜 속도로 발생합니다.
예제
자발적 반응 : 연소 반응은 자발적입니다.
자발적 반응 : 대기 질소와 산소 사이의 반응은 비교 반응의 예입니다.
결론
자발적 및 비 회전 반응은 환경에서 발생하는 두 가지 유형의 화학 반응입니다. 자발적인 반응은 외계입니다. 따라서 엔탈피를 줄이고 시스템의 엔트로피를 증가시킵니다. 그러나, 비 단호한 반응은 엔도 론적이다. 외부 에너지 입력이 진행되기 때문에 시스템의 엔탈피를 증가시킵니다. 그들은 또한 엔트로피를 줄입니다. 그 설명에서, 주어진 화학 반응 세트에서 자발적 반응이 유리하다. 그러나 비교적 반응은 바람직하지 않습니다. 자발적 반응과 비 회전 반응의 주요 차이점은 각 유형의 반응의 열역학적 특성입니다.
참조 :
1.“열역학 법칙.” 열역학의 법칙 | 무한한 화학, 여기에서 사용할 수 있습니다.
2. "11.5 :자발적 반응과 자유 에너지." 화학 LibreTexts, LibreTexts, 2017 년 11 월 1 일, 여기에서 사용할 수 있습니다.
3. "엔도 닉 반응." Wikipedia, Wikimedia Foundation, 2017 년 12 월 16 일, 여기에서 구입할 수 있습니다.
이미지 제공 :
1. FIR0002의 "큰 모닥불"-원래 Commons Wikimedia
2를 통해 저자 (CC By-SA 3.0)가 English Wikipedia에 업로드했습니다. Provenzano15의 "Endergonic Reaction"-Commons Wikimedia를 통한 자신의 작업 (CC By-SA 3.0)