핵심 개념
에너지의 움직임과 전이를 다루는 열역학의 세 가지 기본 법칙이 있습니다. 이 튜토리얼에서 그들에 대해 배우자.
시스템이란 무엇입니까?
열역학의 세 가지 법칙을 탐구하기 전에 시스템과 주변의 개념을 이해하는 것이 중요합니다.
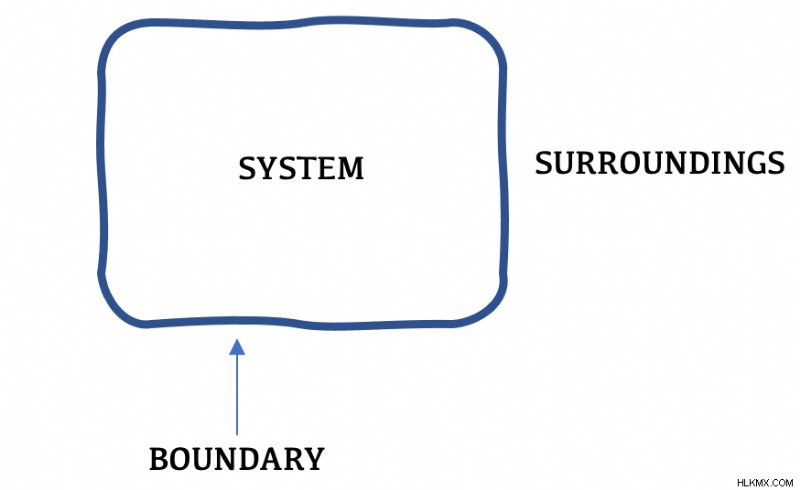
투명한 경계가 그려지면 열역학이 훨씬 쉬워집니다. 경계 내부의 모든 것을 "시스템"이라고하며 경계 외부는 "주변"이라고합니다. 경계 다이어그램이 그려지면 에너지의 움직임과 전달은 흐름 에 의해 특성화 될 수 있습니다. 시스템 경계를 통한 .
“우주”라는 용어는 모두 포괄적입니다. 다시 말해, 시스템과 주변을 모두 말합니다.
시스템 유형
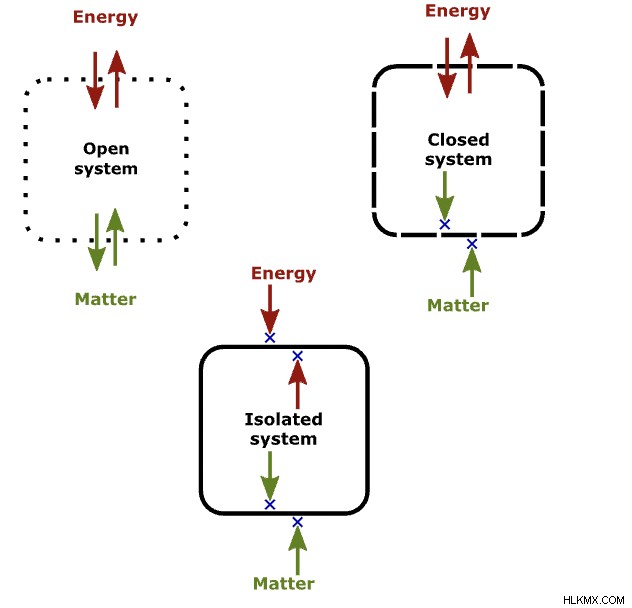
법률 및 교환 유형에 따라 오픈 시스템, 폐쇄 시스템 및 고립 된 시스템의 세 가지 유형의 시스템이 있습니다. 첫째, 개방형 시스템에는 물질과 에너지의 교환이 있습니다. 다음으로 폐쇄 시스템에서는 물질의 교환이 아니라 일부 에너지 교환이 있습니다. 마지막으로, 개방형 시스템에는 물질과 에너지의 교환이 있습니다. 이러한 시스템의 차이점을 이해하는 것은 열역학 법칙을 이해하는 데 중요합니다.
열역학 란 무엇입니까?
열역학은 작업, 열, 온도 및 에너지 사이의 관계를 다루는 물리학의 지점입니다. 또한 열역학은 에너지 형태와 열 에너지가 물질에 미치는 영향 사이에서 열 에너지가 어떻게 변환되는지에 대한 과학을 살펴 봅니다. 열 에너지는 열에서 발생하는 에너지로 정의됩니다.
열역학 법칙 :첫 번째
열역학의 첫 번째 법칙은 다음과 같이 요약됩니다. 에너지를 만들거나 파괴 할 수 없습니다 . 다시 말해, 우주의 총 에너지는 일정하게 유지되거나 보존되어야합니다.
∆U Universe =0
그러나 에너지는 다른 형태를 취한다는 점에 유의해야합니다. 첫 번째 법칙을 재조정하는 또 다른 방법은 에너지의 변화가 시스템 간의 열 흐름 (Q)과 시스템 또는 시스템에서 수행 된 작업과 동일하다는 것입니다.
∆E <서브> 시스템 =Q + W
∂e = ∂ Q + ∂ W 차동 형태
따라서 열과 작업은 시스템의 내부 에너지를 변화시킬 수있는 두 가지 프로세스입니다. 열이 시스템으로 흐르면 Q가 양수입니다. 이것은 시스템에 의해 열이 얻어지고 주변 환경 (흡열 반응)에 의해 동일한 크기의 열이 손실됨을 의미합니다. 열이 시스템에서 흘러 나오면 Q가 음수입니다. 이것은 시스템에 의해 손실 된 열이 주변 환경 (발열 반응)에 의해 얻은 열과 크기가 동일하다는 것을 의미합니다.
같은 생각은 일을위한 것입니다. 주변 환경이 시스템에서 작동하면 작업은 긍정적입니다. 시스템이 주변 환경에서 작동하면 작동은 부정적입니다. 어느 쪽이든, 총 에너지는 여전히 보존되어 있습니다. 이것은 아래에 요약되어 있습니다 :

열역학 법칙 :두 번째
열역학의 제 2 법칙은 엔트로피를 다루고 어느 정도까지 제 1 법칙을 제한합니다. 제 2 법칙에 따르면, 자발적인 과정의 엔트로피가 증가해야하며, 고립 된 시스템으로서 우주의 엔트로피는 항상 증가해야합니다. 최대 엔트로피를 달성한다는 것은 시스템이 평형 상태임을 의미하기 때문입니다. 모든 시스템은 항상 평형에 도달하고 깁스 자유 에너지를 증가 시키려고합니다.
∆S Universe > 0
프로세스를 사용하면 시스템의 엔트로피가 감소 할 수 있지만이 경우 주변의 엔트로피가 증가합니다. 이것은 제 2 법칙을 어 기지 않습니다.
∆S Universe = ∆S
자발적 프로세스
자발적인 과정은 없이 발생하는 과정입니다 모든 입력. 열역학 제 2 법칙에 따르면, 자발적인 과정에서 엔트로피가 증가해야합니다. 엔트로피가 평형에 도달하거나 시스템의 장애가 증가하는 것으로 이해할 수 있습니다.
자발적인 과정의 예는 열에서 차가운 몸으로 이동하는 열입니다. 전체 시스템이 균일 한 온도에 도달하려고하기 때문에 열이 외부 입력없이 자연스럽게 뜨겁게 이동합니다.
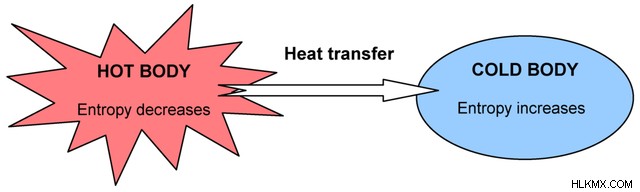
열이 뜨거운 시스템 시스템을 떠날 때 자체 엔트로피가 감소한 다음 콜드 시스템으로 들어감에 따라 엔트로피가 증가합니다. 이것은 자발적인 과정입니다.
반면에, 자발적이지 않은 과정은 엔트로피가 감소하는 과정입니다.
자발성은 속도를 언급하지 않습니다! 간섭없이 자연적으로 발생하는 프로세스를 나타냅니다. 자발적인 과정은 실제로 반응 속도가 매우 느릴 수 있습니다.
열역학 법칙 :세 번째
열역학의 세 번째 법칙은 시스템의 엔트로피가 온도가 절대 0에 접근함에 따라 일정한 값에 가깝다고 주장합니다. 이 법칙은 일반적으로 완벽하게 결정적인 구조의 순수한 물질에 적용됩니다. 최소 에너지는 0 엔트로피에 접근 할 수 있기 때문입니다. 크리스탈이 완벽하지 않거나 0k가 아닌 경우에는 장애로 이어질 열 운동이 있습니다. 튜토리얼

추가 읽기
Hess의 법률 방정식
본드 엔탈피 및 본드 에너지
화학 요소







