핵심 개념
이 튜토리얼에서는 두 가지 제거 반응을 구별하는 6 가지 방법을 배웁니다 , e1 vs e2 .
이 튜토리얼을 살펴보기 전에 반응 자체를 이해해야합니다! E1 제거 및 E2 제거에 관한 기사를 확인하십시오!
다른 기사에서 다루는 주제
- 입체 방해
- 산 및 염기의 특성
- 강산 및 염기
- 친핵체
- electrophiles
어휘
- 중간 - 그런 다음 반응 중에 사용되는 화합물
- 극성 원형 용매 -O-H 또는 N-H 결합을 함유하는 용매
- 입체 화학 - 분자에서 성분의 물리적 방향
- 입체 특이성 - 초기 반응물의 입체 화학은 분자가 최종 생성물의 입체 화학을 반응하고 결정하는 방법에 역할을합니다.
- 기판 - 유기 반응에서의 시작 분자
자, 이제 유기 화학에서 E1을 E2 반응과 구별 할 수있는 6 가지 방법을 배우자!
1. 단계 수
E1과 E2를 구별하는 가장 분명한 방법은 메커니즘의 단계 수를 보는 것입니다. E1은 두 단계로 이루어지며 탄수화물 중간체가 있습니다. 반면에, E2는 한 단계에서 발생하며 중간체가 없습니다.
2. 반응 속도
e1 : 이것은 1 차 단용 분자 반응이므로 이름의 1입니다. 이는 반응 속도가 기질의 농도에만 의존한다는 것을 의미한다. 기판의 농도가 증가함에 따라 반응 속도도 증가합니다.
e2 : 이것은 2 차 이질성 반응이므로 이름의 2입니다. 이것은 반응 속도가 기질과 탈포 톤베이스 모두에 의존한다는 것을 의미합니다.
3. 입체 화학
e1 : 반응의 두 단계가 독립적으로 발생하기 때문에 분자가 공간에 배향되어야하는 구체적인 방법은 없습니다. 따라서 E1은 입체 특이성이 없습니다.
e2 : 분리 될 잎 그룹과 수소는 서로 안티 또는 180도 간격이어야합니다. 반응이 한 단계에서 발생하기 때문에 메커니즘의 각 부분에는 공간이 있어야합니다. 이러한 이유로 두 사람은 우주에 반대 방향을 가져야합니다.
4. 대량의 분자
e1 : 잎 그룹을 분자에 부착하는 탄소를 살펴보면 대량이 많을수록 E1 제거가 더 빨라집니다. 3 차 기질은 가장 빠르며이어서 2 차 기질이 될 것이다. 그러나 1 차 탄수화물은 너무 불안정하여 중간체로 만들어 질 수 없으므로 (자세한 내용은 여기를 클릭하십시오)이 경우 E1 제거는 거의 발생하지 않습니다. 이것은 가장 대체 된 탄수화물이 선호되기 때문입니다. 수소 이외의 분자에 대한 결합이 많을수록 더 안정적입니다. 탄수화물 안정성이 중요합니다.
e2 : E2는 비슷한 순서를 따릅니다. 그러나, 탄수화물 중간체가 없기 때문에, 1 차 기판은 이러한 유형의 제거를 겪을 수있다. 3 차 기질이 가장 선호되고 2 차 기질이 뒤따를 것이며 마지막은 1 차 기판이 될 것입니다.
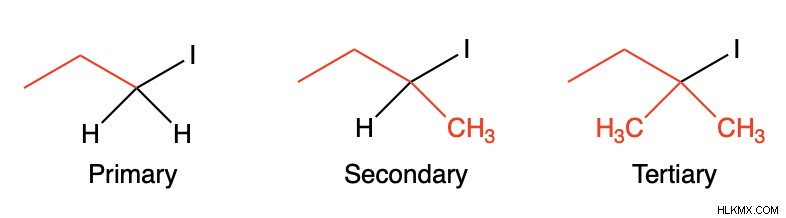
5. 기본 강도
e1 : 친핵체 또는 루이스베이스는 강하거나 약할 수 있습니다. 이 반응은 두 단계로 발생하기 때문에,베이스는 잎 그룹을 대체 할 필요가 없으며 수소를 잡는 데만 집중할 수 있습니다. 물과 같은 약한 염기는 일반적 으로이 반응에 선호됩니다.
e2 : 수산화물 이온과 같은 강력한 염기가 필요합니다. 단일 단계 반응은 극성 잎 그룹의 변위를 돕기 위해 강력한 기초가 필요합니다.
6. 용매
e1 : 극성 제자 용매는 이러한 유형의 제거에 사용됩니다. 이러한 유형의 용매는 이온화에 적합하며 탄수화물 중간체를 안정화시키는 데 도움이 될 수 있습니다.
e2 : 이 반응에서 용매의 유형은 중요하지 않습니다.
E1 대 E2 반응에 대한 추가 독서
- SN1 반응
- SN2 반응
- sn1 vs sn2