핵심 개념
이 튜토리얼에서는 화합물 방향족, 방향족의 힘, 방향족의 일반적인 예, 방향성 화합물 및 중요한 방향족 고리 반응을 만드는 것을 배웁니다.
다른 기사에서 다루는 주제
- 기능 그룹
- 분자 형상
- 공명
- 분자 궤도 이론
어휘
- 방향족 :연속적인 공액 시스템을 갖고 Hückel의 법칙을 만족시키는 순환, 평면 구조.
- 방향 방향 :연속적이고 공액 시스템을 갖고 4N 전자를 갖는 순환, 평면 구조.
- Hückel의 법칙 :4N + 2 PI 전자의 구조를 설명합니다
방향족
방향족 화합물은 주기적이며, 공액 시스템을 갖고, 허클의 법칙을 만족 시키며, 일반적으로 평면 인 화합물로 구성됩니다.
이름에서 알 수 있듯이, 주기적 구조는 분기 체인 구조와는 달리 고리를 형성합니다. 고리 모양 외에도 방향족은 연속 PI 시스템을 포함합니다. 이는 고리가있는 각 원자가 이용 가능한 P 궤도를 가지고 있거나 SP 하이브리드 화되었음을 의미합니다. 따라서 공명이 안정화됩니다.
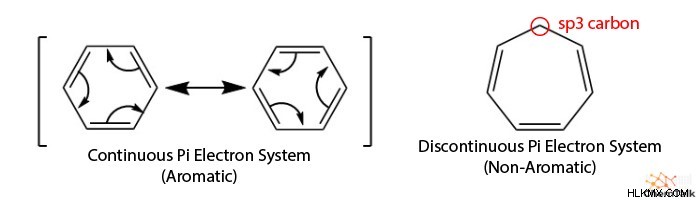
Hückel의 법칙에 따르면 방향족 화합물은 4N + 2 PI 전자 (2, 6, 10, 14 등)를 가져야한다고합니다. PI 전자는 PI 결합에 참여하는 전자이며, 이중 및 삼중 결합에서 볼 수 있으며 P 궤도의 일부입니다. 4N +2는 방향족과 관련된 PI 전자의 수를 제공합니다. not 고리 내의 PI 전자 수를 계산하는 방법.
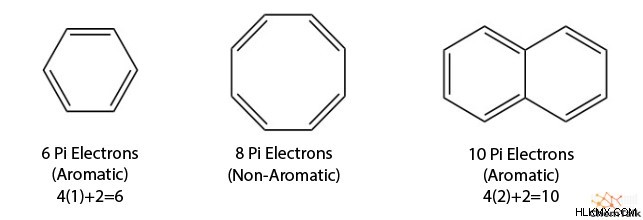
고리에서 PI 전자의 수를 결정하려면 PI 시스템에 기여하는 이중 결합, 음전하 및 고독한 쌍의 수를 계산하십시오. 그런 다음 2를 곱하십시오.
평면 분자는 각 원자가 같은 평면에 위치한 결과로 평평한 분자이다. 방향족 화합물의 경우, 각 원자는 SP 하이브리드 화된다; 따라서 그들은 평면입니다. 원자가 결합 이론 당, 고리 구조는 P 궤도가 전자의 지속적인 움직임을 허용하기 위해서는 평면이어야합니다.
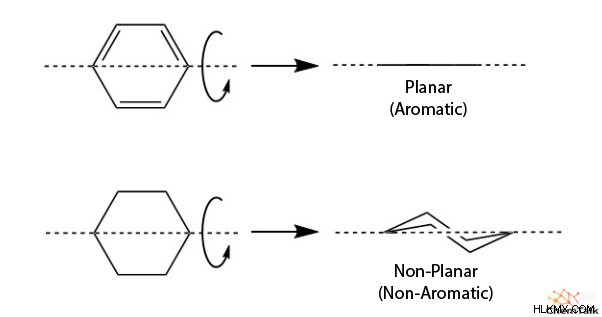
향기의 힘 고리
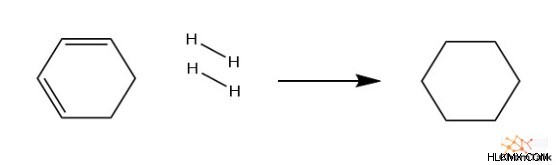
이 4 가지 요인 각각이 결합되면 결과는 각 요인의 합보다 훨씬 안정적입니다. 이를 입증하기 위해 완전히 수소화 된 벤젠과 관련된 엔탈피의 변화를 관찰 해 봅시다. 구체적으로, 이것은 이중 결합이없는 사이클로 헥산을 생성하기 위해 벤젠과 수소 가스를 반응시키는 것을 포함한다. 열량 측정법을 통해 경험적으로 측정 할 때, 반응은 발열이며 208 kJ/mol을 방출합니다.
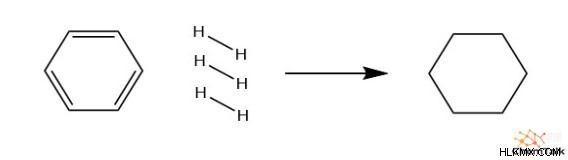
c 6 H 6 + h 2 → C 6 H 12
∆H rxn =-208 kj/mol
이제 사이클로 헥센 (1 개의 이중 결합)과 시클로디 옥 센 (2 개의 이중 결합)의 엔탈피 변화를 관찰 해 봅시다. 하나의 이중 결합에 대해, 반응으로부터 120 kJ/mol이 방출되고, 2 개의 이중 결합, 234 kJ/mol 방출. 우리는 사이클로 헥센보다 사이클로 헥사 디엔을 수소화하여 에너지가 약 두 배나 방출되는 추세를 볼 수 있습니다.
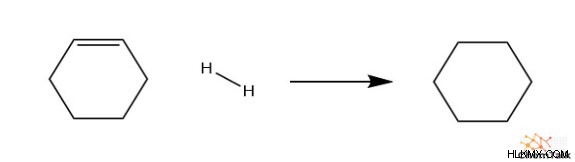
c 6 H 10 + h 2 → C 6 H 12
∆H rxn =-120 kj/mol
c 6 H 8 + h 2 → C 6 H 12
∆H rxn =-234 kj/mol
벤젠이 단순히 3 개의 이중 결합으로 사이클로 헥산 인 경우, 3 개의 이중 결합 각각에 대해 수소화 엔탈피가 약 360 kJ/mol과 동일 할 것으로 예상됩니다. 대신, 언급 한 바와 같이, 208 kJ/mol의 에너지가 방출됩니다. 화학자들은 이것을 벤젠의“공명 에너지”에서 150 kJ/mol 차이라고 부릅니다. 우리가 볼 수 있듯이, 방향족은 분자 구조와 관련된 기존의 통찰력으로 표시된 것 이상의 안정성을 제공합니다.
방향족 고리 예
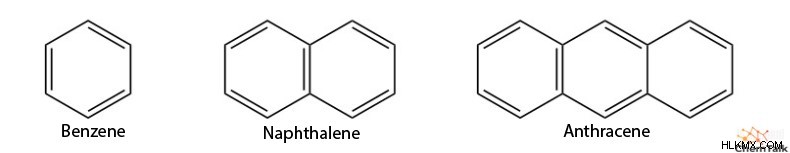
벤젠은 가장 잘 알려진 방향족 분자 역할을하지만, 더 많은 방향족 구조가 존재합니다. 중요하게도, PI 전자는 주기적으로 이동하는 능력이 있어야하지만 동일한 방향족 시스템 내에 다중 사이클이 존재할 수 있습니다. 예를 들어, 나프탈렌 및 안트라센과 같은 분자는 방향족 구조로 계산됩니다.
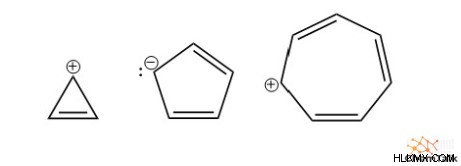
또한, 많은 이온 구조는 총 전자 수가 Hückel의 법칙을 따르는 한 방향족성을 가지고 있습니다. 주목할만한 예는 사이클로 프로 페닐 양이온, 시클로 펜타 디엔 음이온 및 시클로 헵 타트리 에닐 양이온을 포함한다.
.
흥미롭게도, 방향족성의 열역학적 유리성으로 인해, 사이클로 펜타 디엔과 같은 분자는 그들의 SP 탄소에 부착 된 다소 산성 수소 (PKA =16)를 갖는다.
.
또한, 이종 사이 클릭 화합물은 또한 푸란, 옥사졸 및 퓨린과 같은 방향족성을 가질 수있다.
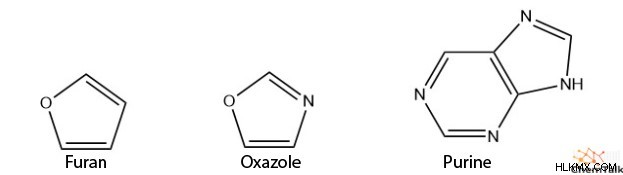
또한 Cyclopentadiene 음이온뿐만 아니라 많은 헤테로 사이 클릭 화합물이 고리 부재 중 하나에 4 개의 전자가 있음을 알 수 있습니다. 이것은 일반적으로 SP 혼성화를 나타내지 만,이 경우, 이들 원자는 여전히 p 궤도에 고독한 전자 쌍이있는 SP 혼성화를 가지고있다.
.반 방향 화합물
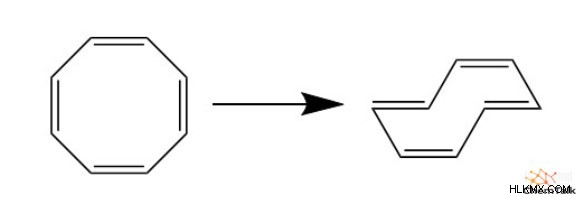
방향족은 약간의 안정성을 제공하지만 불안정성을 추가 한 유사한 화합물도 존재합니다. 화학자들은이 화합물을“반응성”이라고 부르며, 안정적인 대응 물과 마찬가지로 연속 PI 시스템을 갖춘 평면, 주기적 구조를 가지고 있습니다. 그러나 Hückel의 법칙을 따르지 않고이 화합물에는 4N Pi 전자가 있습니다. 항 방향 화합물의 전형적인 예는 사이클로 부타디엔이며, 이는 너무 불안정하여 비 홍수 조건 하에서 자발적으로 거의 분해됩니다.

실제로, 사이클로 티테트라 엔과 같은 더 큰 항 아로마 성 화합물은 대신 주름진 구조를 개발한다. 이것은 멤버 탄소 사이의 입체 장애를 증가 시키지만, 그러한 주름은 평면 방지 구조보다 훨씬 더 안정성을 가지고 있습니다.
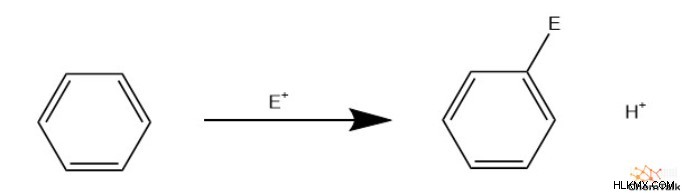
방향족 치환 반응
독특한 방향족 화학으로 인해 화학자들은 많은 용도를 조작했습니다. 그러나, 이것은 일반적으로 일부 치환 된 방향족 화합물을 포함한다. 이것은 주로 전자 성 방향족 치환을 통해 발생하여 할로이드, 니트로, 아실 및 탄화수소와 같은 그룹의 부착을 허용합니다.
치환기는 또한 친 핵성 방향족 치환을 통해 고리에 부착 될 수있다. 이것은 알코올, 아미노 및 기타의 부착을 허용합니다.