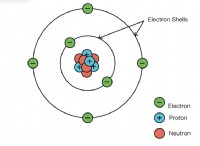
주요 차이 - Aufbau 원칙 대 헌드의 규칙
원자 구조의 발달은 Dalton의 현대 원자 이론으로 시작되었습니다. 모든 물질은 원자로 만들어지고 원자는 더 작은 입자로 더 나눌 수 없다고 언급했다. 그러나, 나중에 원자는 J.J.에 의해 전자를 발견 한 후 원자가 입자로 더 나눌 수 있음이 밝혀졌다. Thompson, Rutherford의 핵 발견과 Niels Bohr의 전자 궤도 개념. 현재 허용되는 원자의 구조에는 전자 쉘, 서브 쉘 및 궤도에 대한 세부 사항이 포함됩니다. 전자가 이러한 껍질과 궤도에 채우는 방식은 Aufbau 원리와 Hund의 규칙을 사용하여 설명 할 수 있습니다. aufbau 원칙과 헌드의 규칙의 주요 차이점은 aufbau 원칙 원칙은 서브 쉘이 전자로 채워지는 순서를 나타내는 반면 헌드의 규칙은 서브 쉘의 궤도가 채워진 순서를 나타냅니다.
주요 영역을 다루었습니다
1. aufbau 원칙
- 이론, 예에 대한 설명
2. 헌드의 규칙은 무엇입니까
- 이론, 예에 대한 설명
3. Aufbau 원칙과 헌드의 규칙의 유사점은 무엇입니까
- 일반적인 기능의 개요
4. Aufbau 원칙과 헌드의 규칙의 차이점은 무엇입니까
- 주요 차이점 비교
주요 용어 :Atom, Aufbau 원리, 전자, 헌드의 규칙, 궤도 
aufbau 원리
aufbau 원리는 전자를 원자의 서브 쉘로 채우는 순서가 가장 낮은 에너지 수준에서 가장 높은 에너지 수준까지 발생한다고 명시합니다. 다시 말해, 전자가 원자의 궤도에 채워질 때, 전자는 먼저 높은 에너지 수준을 채우기 전에 가장 낮은 에너지 수준에있는 궤도를 채 웁니다.
일반적으로 에너지는 쉘 레벨에서 1 <2 <3 <4의 순서가 증가하고 궤도 레벨에서 s
.
예상 주문
1s <2s <3s <3p <3d <4s <4p <4d <5s…
실제 주문
1s <2s <3s <3p < 4s <3d <4p < 5s <4d…
그러나 각 궤도의 에너지 수준을 하나씩 기억하기가 어렵습니다. 따라서 다음 다이어그램을 사용하여 에너지 레벨을 쉽게 결정할 수 있습니다.
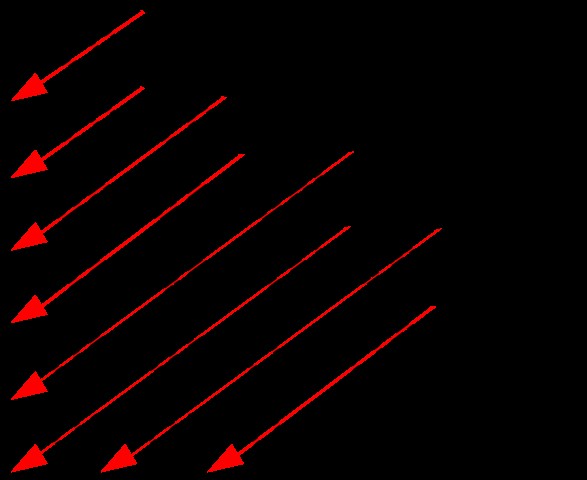
그림 1 :궤도의 에너지 수준의 순서
위의 이미지는 에너지 수준 결정을위한 다이어그램을 보여줍니다. 여기서, 우리는 화살표의 경로를 따라 궤도의 순서를 얻을 수 있습니다. 각 화살표 머리 후에 다음 화살로 시작하십시오. 이런 식으로 에너지 수준을 쉽게 얻을 수 있습니다.
헌드의 규칙이란 무엇인가
헌드의 규칙은 서브 쉘의 궤도로 채워진 전자 순서를 설명합니다. 서브 쉘은 궤도로 구성됩니다. 한 서브 쉘에 존재하는 궤도의 수는 한 서브 쉘과 다릅니다. 예를 들어, S 서브 쉘에는 하나의 s- 궤도가 있고, p 서브 쉘에는 3 개의 p- 궤도가 있으며, d 서브 쉘은 5 개의 d- 궤도로 구성됩니다. 따라서,이 궤도를 전자로 채우는 순서가 있어야한다. 그렇지 않으면,이 원자들은 불안정해진다.
하나의 궤도는 최대 2 개의 전자를 담을 수 있습니다. Hund의 규칙에 따르면, 같은 서브 쉘의 모든 궤도는 먼저 쌍을 취하기 전에 전자에 의해 먼저 점유됩니다. 즉, 전자는 먼저 짝을 이루지 않은 전자로 채워진 다음 결합된다는 것을 의미합니다. 따라서 전자를 궤도에 할당 할 때이 규칙을 따릅니다. 동일한 서브 쉘에 전자 쌍과 빈 궤도가있는 궤도가있는 경우, 전자가 동일한 궤도에있을 때 전자가 부정적인 하전되고 서로 격퇴되기 때문에 불안정한 구성이기 때문입니다. 따라서, 전자는 전자 사이의 반발이 최소화되는 방식으로 배열되는 경향이있다.
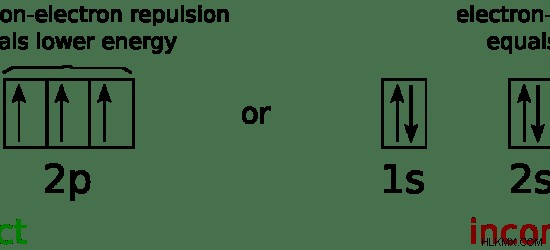
그림 2 :궤도를 차지하는 전자
이 규칙은 전자가“스핀”과 일치하는 방식으로 궤도에 채워져 있다고 설명합니다. 다시 말해, 동일한 서브 쉘의 단독으로 점유 된 궤도의 전자는 동일한 스핀을 갖는다. 이들 전자가 쌍을 이루면, 2 개의 전자는 반대쪽 스핀을 가지고있다. 전자 쌍의 한 전자는 "스핀 업"인 반면 다른 전자는 "스핀 다운".
.
그림 3 :궤도에서 전자의 스핀
궤도가 단독으로 점유되면 그 전자는 "스핀 업"또는 "스핀 다운"될 수 있습니다. 그러나, 그 전자가 쌍을 이루면, 다른 전자는이 전자와 반대 스핀을 가져야한다. 이런 식으로 반발은 최소화됩니다.
aufbau 원칙과 헌드의 규칙 사이의 유사성
- aufbau 원리와 헌드의 규칙은 원자의 에너지 레벨이 전자로 채워진 순서를 나타냅니다.
aufbau 원칙과 헌드의 규칙의 차이
정의
aufbau 원칙 : Aufbau 원리는 원자의 서브 쉘이 전자로 채워진 순서를 설명합니다.
헌드의 규칙 : Hund의 규칙은 서브 쉘의 궤도가 전자가 채워진 순서를 설명합니다.
이론
aufbau 원칙 : Aufbau 원칙에 따르면, 서브 쉘은 가장 낮은 에너지 수준에서 가장 높은 에너지 수준으로 채워집니다.
헌드의 규칙 : Hund의 규칙에 따르면, 궤도는 먼저 전자에 의해 단독으로 점유되고 있으며, 스핀에 따라 쌍을 이룹니다.
에너지 수준
aufbau 원칙 : Aufbau 원리는 전자가 서브 쉘을 채우는 방식을 설명합니다.
헌드의 규칙 : Hund의 규칙은 전자가 서브 쉘의 궤도를 채우는 방식을 설명합니다.
반발
aufbau 원칙 : Aufbau 원리는 전자 사이의 반발 최소화를 설명하지 않습니다.
헌드의 규칙 : Hund의 규칙은 전자 사이의 반발을 최소화하는 방법으로 전자가 어떻게 채워 지는지를 나타냅니다.
결론
aufbau 원리와 헌드의 규칙은 특정 원자의 원자 구조를 개발하는 데 매우 중요합니다. 전자의 수가 특정 원자에 대해 알려져 있다면, 우리는 위의 이론을 사용하여 해당 원자에 배열 된 패턴을 결정할 수 있습니다. Aufbau 원칙과 헌드의 규칙의 주요 차이점은 Aufbau 원칙 원칙은 서브 쉘이 전자로 채워지는 순서를 나타내는 반면 Hund의 규칙은 전자가 서브 쉘에서 궤도를 채우는 방식을 나타냅니다.
.