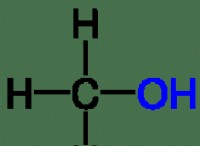
4AL + 3O2-> 2AL2O3
방정식으로부터, 우리는 3 몰의 O2가 4 몰의 AL과 반응하여 2 몰의 Al2O3을 생성해야 함을 알 수있다.
따라서 0.78 mol의 O2가 반응하면 화학량 론을 사용하여 형성된 Al2O3의 두더지 수를 계산할 수 있습니다.
AL2O3의 두더지 =(O2의 몰스 반응) * (AL2O3의 몰이 생성 된 O2의 MOLES)
Al2O3의 두더지 =(0.78 mol) * (2 mol al2o3 / 3 mol O2)
Al2O3의 두더지 =0.52 mol
따라서, 0.78 mol의 O2가 알루미늄과 반응 할 때 0.52 몰의 Al2O3가 형성된다.