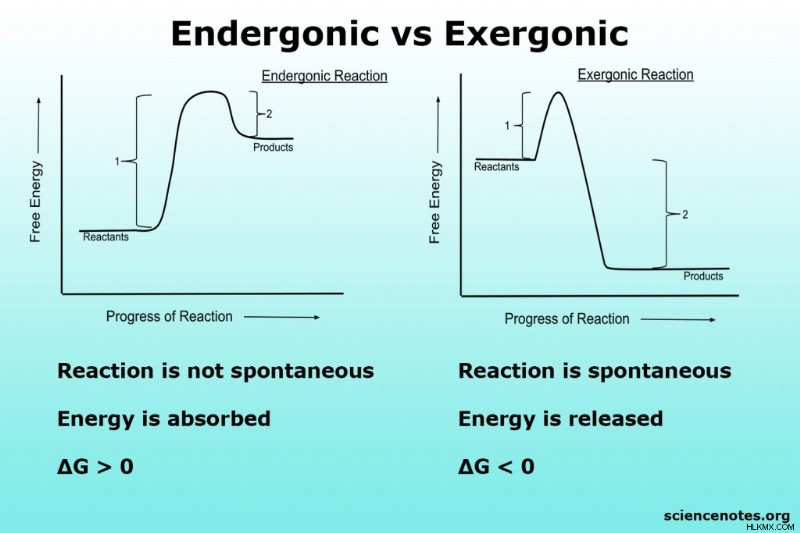
endergonic 및 exergonic 반응은 깁스 자유 에너지의 변화에 따라 정의됩니다. endergonic 반응에서, 생성물의 자유 에너지는 반응물의 자유 에너지보다 높습니다 ((∆G> 0; 에너지는 생성물에 에너지가 저장됩니다), 반응은 자발적이지 않으며 추가 에너지가 반응을 진행하기 위해 공급되어야합니다. 반응의 자유 에너지는 생성물의 자유 에너지보다 높습니다 (∆G <0). 자발적.
다음은 Endergonic 및 Exergonic 반응, 각 유형의 예 및 반응이 어떻게 결합되어 바람직한 반응이 발생하도록하는 방법에 대한 자세한 내용입니다.
엔도 닉 반응
endergonic 반응은 일정한 온도 및 압력에서 긍정적 인 표준 Gibbs 자유 에너지를 가진 화학 반응입니다.
∆G °> 0
다시 말해, 자유 에너지의 순 흡수가 있습니다. 제품의 화학적 결합은 에너지를 저장합니다. endergonic 반응을위한 활성화 에너지는 일반적으로 전체 반응의 에너지보다 더 크기 때문에, 엔도 닉 반응은 또한 바람직하지 않거나 비 단방 반응이라고도합니다. 깁스 자유 에너지는 평형 상수와 관련이 있기 때문에 k <1.
불리한 반응을 진행하는 방법에는 여러 가지가 있습니다. 반응을 가열하여 에너지를 공급하거나,이를 엑서닉 반응과 결합 시키거나, 유리한 반응으로 중간체를 공유하게 할 수 있습니다. 시스템에서 제품을 제거하여 반응을 당할 수 있습니다.
endergonic 반응의 예로는 광합성, 근육 수축 및 신경 전도를위한 NA/K 펌프, 단백질 합성 및 염화 칼륨 용해가 물에 포함됩니다.
.Exergonic 반응
exergonic 반응은 일정한 온도 및 압력에서 음성 표준 깁스 자유 에너지를 가진 화학 반응입니다.
∆G ° <0
다시 말해, 자유 에너지의 순 방출이 있습니다. 반응물의 화학적 결합을 파괴하면 제품에 새로운 화학적 결합을 형성하는 데 사용 된 것보다 더 많은 에너지가 방출됩니다. 엑서닉 반응은 엑소 성, 유리한 또는 자발적 반응으로도 알려져 있습니다. 모든 반응과 마찬가지로, 진행을 위해 엑서닉 반응을 위해 공급되어야하는 활성화 에너지가있다. 그러나 반응에 의해 방출 된 에너지는 활성화 에너지를 충족시키고 반응을 계속하기에 충분하다. 엑서닉 반응은 자발적이지만 촉매의 도움 없이는 빠르게 진행되지 않을 수 있습니다. 예를 들어, 철의 녹는 것은 외계인이지만 매우 느립니다.
엑소 소닉 반응의 예로는 세포 호흡, 과산화수소의 분해 및 연소가 포함됩니다.
endergonic/exergonic vs wenthermic/xothermic
흡열 및 발열 반응은 각각 endergonic 및 exergonic 반응의 유형입니다. 차이는 흡열 반응에 의해 흡수되거나 발열 반응에 의해 방출되는 에너지는 열이다. Endergonic 및 Exergonic 반응은 빛이나 소리와 같은 열 외에 다른 종류의 에너지를 방출 할 수 있습니다. 예를 들어, 글로우 스틱은 빛을 방출하는 exergonic 반응입니다. 열이 방출되지 않기 때문에 발열 반응이 아닙니다.
전방 및 역 반응
반응이 한 방향으로 엔도 론적이면 다른 방향으로는 엑사 닉입니다 (그리고 그 반대도 마찬가지). 이러한 반응에서, 엔도 닉 및 엑소 소닉 반응을 가역적 반응이라고 할 수있다. 자유 에너지의 양은 전방 및 역 반응 모두에 대해 동일하지만, 에너지는 endergonic 반응에 의해 (양성) 흡수되고 엑서 닉 반응에 의해 방출됩니다 (음성). 예를 들어, 아데노신 트리 포스페이트 (ATP)의 합성 및 분해를 고려하십시오.
ATP는 인산염에 결합하여 만들어집니다 (p i ) 아데노신 디스 인산 (ADP)에 :
adp + p i → atp + h 2 영형
이 반응은 ∆ g 과 함께 엔도 닉이다 =+7.3 표준 조건 하에서 kcal/mol. 역 프로세스 인 ATP의 가수 분해는 깁스 자유 에너지 값이 크기와 동일하지만 -7.3 kcal/mol :
ATP + H 2 O → ADP + P I
커플 링 엔도 닉 및 엑서닉 반응
화학적 반응은 화학적 평형에 도달하고 전방 및 역 반응이 동일한 속도로 진행될 때까지 순방향 및 역 방향으로 진행됩니다. 화학 평형에서 시스템은 가장 안정적인 에너지 상태에 있습니다.
평형은 세포가 발생하기 위해 대사 반응이 필요하거나 다른 죽음이 필요하기 때문에 생화학에 나쁜 소식입니다. 세포는 생성물 및 반응물의 농도를 제어하여 당시에 필요한 반응의 방향을 선호한다. 따라서 셀이 ATP를 만들려면 에너지를 공급하고 ADP를 추가하거나 ATP와 물을 제거해야합니다. ATP를 에너지로 계속 변환하려면 셀은 반응물을 공급하거나 제품을 제거합니다.
종종, 하나의 화학 반응은 다음에 공급되며, 엔도 닉 반응은 외출 반응과 결합되어 그들에게 충분한 에너지를 제공합니다. 예를 들어, Firefly Bioluminescence는 Exergonic ATP 방출과 결합 된 Luciferin의 Endergonic 발광으로 인한 결과입니다.
참조
- Hamori, Eugene (2002). "생체 에너지를위한 기초 구축." 생화학 및 분자 생물학 교육 . 30 (5) :296-302. doi :10.1002/bmb.2002.494030050124
- 하모리, 유진; 제임스 E. 뮬 드리 (James E. Muldrey) (1984). “엑서닉 반응에 대한 설명을 위해“자발적”대신“열심”이라는 단어의 사용. 화학 교육 저널 . 61 (8) :710. doi :10.1021/ed061p710
- iupac (1997). 화학 용어의 개요 (제 2 판) (“골드 북”). ISBN 0-9678550-9-8. doi :10.1351/Goldbook