핵심 개념
이 튜토리얼에서는 단백질 구조를 구성하는 것이 무엇인지, 온도 및 pH와 같은 요인이 단백질의 안정성에 어떤 영향을 미치는지 배웁니다. 또한 단백질 구조와 안정성이 단백질의 기능에 중요하다는 것을 알게 될 것입니다.
다른 기사에서 다루는 주제
- 아미노산 차트
- 세포 신호 란 무엇입니까?
- GPCR - G 단백질 결합 수용체
- 효소 - 기능 및 유형
- 당분 해 :분해합시다!
단백질 구조와 안정성이란 무엇입니까?
단백질 구조 단백질이 취하는 특정 모양을 설명합니다. 단백질은 구조에서 매우 단단하거나 매우 편안하거나 그 사이 어딘가에있을 수 있습니다. 수소 결합과 같은 화학적 상호 작용은 접착제처럼 작용하여 이러한 구조를 함께 유지합니다. 단백질의 1 차 아미노산 서열은 이러한 화학적 상호 작용 중 어느 것이 형성 될 수 있는지, 어디에서.
를 결정하는 데 큰 요인이다.단백질은 역동적입니다. 그들은 항상 움직이고 있습니다! 이것은 원자 진동과 같은 작은 움직임이나 단백질이 전체 형태를 변화시키는 것과 같은 더 큰 움직임을 의미 할 수 있습니다. 단백질 안정성 단백질이 얼마나 잘 어울리는 지에 대한 척도입니다. 다시 말해, 단백질이 특정 모양을 얼마나 효과적으로 유지하는지입니다. 단백질은 일반적으로 몇 가지 안정적인 모양을 가정 할 수 있습니다. 생화학 자들은 세포에서와 같이 생물학적 조건에서 단백질이 점유하는 것에 계속 관심을 갖고 있습니다.
단백질 구조
단백질 구조가 중요한 이유는 무엇입니까?
인체에는 수만 개의 단백질이 있습니다. 그들은 모두 다른 역할을 가지고 있으며, 많은 사람들은 삶에 필수적입니다. 다른 역할을 결정하는 것은 무엇입니까? 단백질의 모양은 그것이 어떻게 행동하는지의 주요 요인입니다. 예를 들어, 헤모글로빈은 신체의 산소를 흡수, 운반 및 방출 할 수있는 모양을 가지고 있습니다. 그러나 단백질 케라틴은 헤모글로빈처럼 보이지 않으며 산소를 운반 할 수 없습니다. 대신 머리카락과 손톱을 구성하는 강한 섬유를 형성합니다.
단백질 구조를 결정하는 것은 무엇입니까?
단백질은 자신과의 상호 작용을 형성합니다.
단백질을 구성하는 아미노산에는 화학적 특성이있어 모양을 유지하는 데 도움이됩니다. 예를 들어, 단백질의 1 차 구조에서, 아미노산은 공유 결합을 통해 함께 연결되어 길고 내구성있는 사슬을 형성한다. 또한이 아미노산은 아래 표에서와 같이 다른 유형의 상호 작용을 형성하여 더 복잡한 전체 모양을 유지하는 데 도움이됩니다.
단백질 구조는 접착제처럼 작용하는 기본 화학적 상호 작용에 기반을두고 있습니다. 여기에는 이온 성 결합, 수소 결합, 반 드 발절 힘 및 이황화 결합이 포함됩니다. 아래 표는이 세력에 대한 훌륭한 소개입니다. 그러나 전체 목록은 아닙니다. 예를 들어, 아미노산은 Pi-Stacking이라는보다 복잡한 접촉을 겪을 수 있습니다.
| 단백질 상호 작용 | 설명 |
| 이온 결합 | 이온 결합은 전하에 기초한 원자 또는 분자 사이에 형성됩니다. 아미노산 측쇄 또는 R 그룹은 양전하 (라이신과 같은), 음전하 (아스파르트산과 같은) 또는 중성 (글리신)이 있습니다. 양으로 하전 된 아미노산은 음으로 하전 된 아미노산을 유발합니다. 보다 일반적으로, 단백질의 양성 영역은 음성 영역을 유치하여 강한 이온 결합을 형성합니다. | .
| 수소 결합 | 수소 결합은 약간 양성 수소 원자 (산소, 질소 또는 불소에 부착 된)와 다른 O, N 또는 F 원자 사이에 형성되는 강한 정전기 상호 작용입니다. 이것들은 많은 생물학적 분자에 대한 중요한 상호 작용입니다. |
| van der waals | van der waals 또는 런던 분산은 힘이 약하며 매우 가까운 근접성에서 발생합니다. 여기서 가장 약한 상호 작용이지만 여전히 단백질의 구조를 유지하는 데 중요한 역할을합니다. | .
| 이황화 결합 | 이황화 결합은 아미노산, 시스테인에서 일반적으로 발견되는 황 원자 사이의 공유 결합이다. 이황화 이황화 연계 또는 교량이라고도 불리는 이들은 단백질에서 아미노산 사이의 연결을 형성하는 또 다른 방법입니다. | .
| 요소 | 설명 |
| 용매 | 용매는 다양한 특성을 포함 할 수 있으며,이 모든 특성은 단백질의 구조에 영향을 미칩니다. 알코올 (-OH)을 갖는 용매는 단백질 구조에서 수소 결합을 형성하고 방해 할 수 있습니다. 용매 수는 소수성 효과를 촉진합니다. |
| ph | pH는 아미노산이 산, 염기 또는 중성 종으로서 작용하는지 여부를 결정한다. 이것은 아미노산의 전하 (및 전체 단백질의 전하)에 영향을 미칩니다. pH의 변화는 정전기 상호 작용과 같이 전하에 의존하는 연결을 방해 할 수 있습니다. 아미노산이 산/염기 화학을 겪을 때, 그들은 또한 양성자를 얻거나 잃고 있으므로, pH는 수소 결합과 같은 수소에 의존하는 연결을 방해 할 수있다. | .
| 염분 | 염분은 NaCl뿐만 아니라 용액에 얼마나 많은 소금이 존재하는지를 측정합니다. 소금의 이온은 아미노산의 전하를 안정화시키는 데 도움이 될 수 있기 때문에 낮은 수준의 소금은 일반적으로 단백질 폴딩에 도움이됩니다. 그러나, 높은 수준의 소금은 단백질이 접어야하는 상호 작용을 방해 할 수 있습니다. |
| 요소 | 설명 |
| 온도 | 고온은 또한 단백질 구조를 보유하는 상호 작용을 방해 할 것입니다. 단백질은 일반적으로 낮은 온도에서 안정적입니다. 예를 들어, 이것은 극저온 선거 현미경 (cryo-em)과 같은 단백질 영상 방법에서 활용됩니다. |
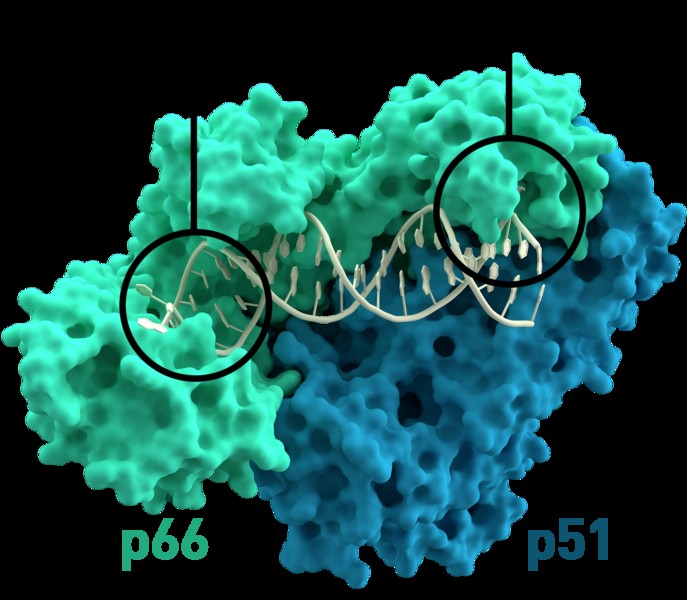
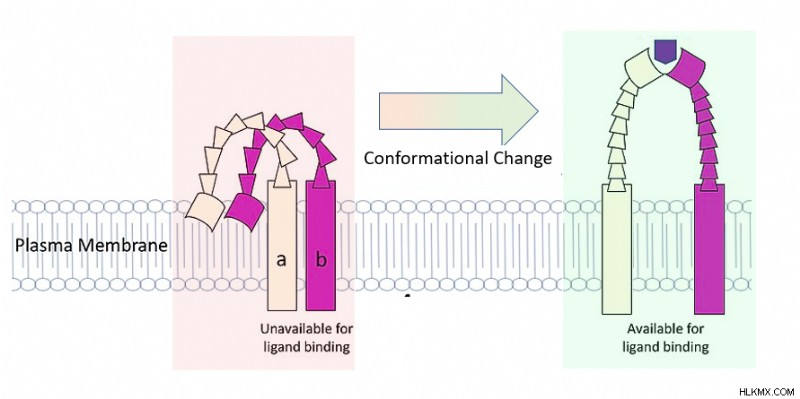
| 분자 | 이보다 일반적인 범주에는 단백질, 작은 신호 전달 분자 및 소금이 포함됩니다. 단백질은 역전사 효소의 경우와 같이 안정성을 위해 다른 단백질에 의존 할 수 있습니다. 또한 접힘, 세포 수송, 신호 및 기타 기능을 위해 다른 단백질에 의존 할 수 있습니다. 이것은 종종 단백질 모양의 변화가 수반됩니다. 작은 신호 전달 분자는 단백질의 작은 영역에서 화학에 영향을 줄 수 있으며, 이는 다양한 영향의 단백질 구조 변화를 초래할 수 있습니다. | .