화학 물질 삼산화 황 (Nisso Sulfan이라고도 함)에는 포뮬러 SO3 (대체 철자 :황 황)이 있습니다. 황 산화 황에 따르면“의심 할 여지없이 상업적으로 가장 중요한 것”. 그것은 황산의 전구체로서 막대한 양으로 생산된다. 황 삼산화황은 기체 단량체, 결정질 삼량 체 및 고체 중합체를 포함한 다양한 형태로 제공됩니다. 황 삼산화황은 주변 온도보다 약간 낮은 좁은 액체 범위로 고체입니다. 산성 비는 대부분 기체 SO3에 의해 발생합니다. 루이스 구조는 분자의 원자가 쉘 전자의 묘사입니다. 분자의 전자가 어떻게 분포되는지 묘사하는 데 사용됩니다. 가장 흥미로운 주제는 삼산화황의 분자 기하학입니다.
삼산화황의 분자 기하학
분자를 형성하는 데 도움이되는 원자의 3 차원 구조는 분자 기하학으로 알려져 있습니다. 그것은 무엇보다도 반응성, 극성, 색상, 매력 및 생물학적 활동에 대해 알려줄 수 있습니다.
트라이 산화 황에서는 1 개의 황 원자와 3 개의 산소 원자가 가능한 한 멀리 떨어져 있습니다! 전자는 산소 원자를 둘러싸고 있습니다. 음성 전자는 음의 전자를 반발합니다.
axn은 SO3의 분자 기하학을 기억하는 또 다른 방법입니다.
- 중앙 원자 인 Sulfur는 문자 A로 표시됩니다.
- 문자 X는 중앙 황에 결합 된 원자의 수를 나타냅니다.
- 모든 비 결합 전자 쌍은 문자 n으로 표시됩니다.
- 이 SO3 공식에는 비전도 결합 전자가 없기 때문에 N에 대해 걱정할 필요가 없습니다. 또한 세 가지 산소 원자가 있기 때문에 결과는 x3입니다. .
결과적으로 SO3 분자는 ax3 을가집니다. (그건 그렇고, 이것이 SO3가 삼각 평면 형태를 갖는 이유입니다.) SO3는 결합 각인이 120도입니다.
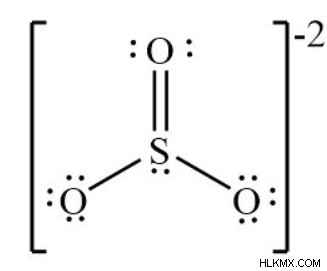
SO3 분자 기하학-루이스 구조
- 각 원자가 방정식에 기여하는 원자가 전자 수를 계산합니다. SO3에는 총 24 개의 전자가 있습니다. SO3 2-는 총 26 개의 전자를 가지고 있습니다.
- 중간에 전기 음성 전하가 가장 적은 원자를 배치하십시오. 유황은 두 상황 모두에 존재합니다.
- 황 원자를 둘러싼 더 전기 음성 원자를 넣을 때 그 중 세 가지가 있습니다.
- 각 원자 주위에 2 개의 쌍으로 6 개의 원자가 전자를 그립니다 (모두 6 개가 있기 때문에)
- 하나의 황 원자와 3 개의 산소 원자 사이에 총 12 개의 전자가 있습니다.
- 이중 채권을 만듭니다. 단일 결합은 두 개의 전자를 형성해야합니다. 이중 결합은 4 개의 전자를 형성해야합니다.
- 황화제에 대한 세금은 없습니다. 황은 산소에 비해 약하기 때문에 전자 음성이기 때문에 전자를 산소 원자에 항복합니다.
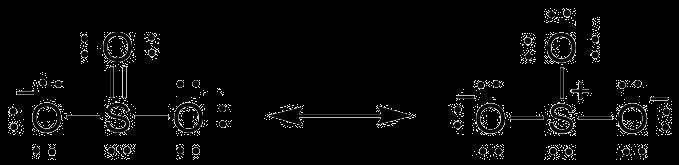
SO3 분자 기하학-SO3가 이중 결합을 생성하는 원인인가?
화학 물질 삼산화 황은 삼각 평면 구조를 가지고 있습니다. 황은 산소보다 전기 음성이 적기 때문에 분자의 중심을 차지합니다. 그것은 6 개의 전자를 가지고 있으며 3 개의 산소 원자와 공유하여 이중 결합을 형성합니다.
황은 옥넷 규칙을 어떻게 깨뜨린가?
So3 분자 형상에서 황의 원자가 전자 수는 6입니다. 3S 궤도에는 2가 존재하는 반면, 3p 궤도에는 4가 존재한다. 8 개의 원자가 전자를 생성하려면 3p 궤도에 2 개의 추가 전자가 필요합니다. 일반적으로, 이것은 황화 불소에 대한 예상 공식이 SF4가 아닌 SF2임을 암시합니다. 반면, Sulfur의 3 번째 에너지 수준 전자는 3D Sublevel에 접근 할 수 있습니다. 이는 8 개 이상의 전자가 원자가 전자로지지 될 수 있음을 의미합니다.
결과 궤도는 하이브리드이기 때문에 "dsp3 하이브리드 화"라고합니다. 황 주변에는 1 개의 고독 쌍과 4 개의 결합 쌍의 원자가 전자가 있습니다. D SUBLEVEL은주기 테이블의 처음 두 기간 동안 요소에 액세스 할 수 없습니다. 결과적으로 옥트 규칙을 따릅니다.
So3
의 혼성화SO3에는 SP2 혼성화가 있습니다. 다음 공식을 사용하여 계산됩니다.
시그마 본드 수 + 고독한 쌍의 수 =하이브리드 궤도 수
하나의 시그마 본드와 하나의 pi 결합은 단일 공유 이중 공유 결합에 존재합니다.
따라서 단일 SO3 분자에는 3 개의 시그마 본드와 제로 린 쌍 (루이스 구조로 확인)이 있습니다.
결과적으로, 하이브리드 궤도의 수는 3 + 0 =3입니다. 원자 오버랩 내에서 동일한 쉘의 하나의 궤도 및 2 개의 p 궤도가 SP2 하이브리드에서 비교 가능한 에너지의 3 가지 새로운 하이브리드 궤도를 형성합니다.
결론
주기 테이블의 기간 3은 옥트를 연장하고 8 개 이상의 원자가 전자를 수용하는 경향이있는 요소로 특징 지어집니다. 두 가지 요소를 제외하고 대부분의 요소가 그것을 보여주기 때문에이 행동은 드문 일이 아니라는 점에 주목할 만하다. 하나의 시그마 결합 및 하나의 PI 결합이 SO3에서 형성되기 때문에, 하이브리드 화는 SP2이다. 이것은 SO3 분자 구조 및 SO3 분자 구조 및 결합 각 예제에 대한 모든 정보였습니다. 따라서 SO3은 120 도의 결합을 형성하는 비극성 분자임을 분명히 알 수 있습니다.