소개
계란 흰자는 알부민으로 알려진 막대한 양의 단백질을 포함하고, 알부민은 전형적으로 단백질에서 상이한 아미노산 사이의 링크가 형성 된 결과로서 별개의 3 차원 형태를 갖는다. 가열의 결과로, 이들 연결이 파손되어 이전에 단백질 내부에 숨겨져 있던 소수성 (물 증오) 아미노산을 노출시킨다. 계란 흰색으로 주변의 물에서 벗어나려고하는 동안 소수성 아미노산은 서로 부착되어 달걀 흰자위 구조를 제공하는 단백질 네트워크가 형성되면서 흰색과 불투명하게 만듭니다.
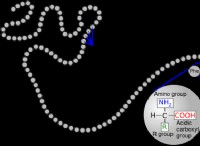
.하나의 분자의 아민 그룹과 다음 분자의 카르 복실 그룹 사이의 펩티드 결합 (-CO-NH)의 형성에 이어 반응으로부터 물 분자가 제거된다. 다른 모든 측면에서 이것은 아미드 연결입니다. 길이가 10 개 이상인 아미노산 사이에 펩티드 결합이 형성 될 때, 생성 된 폴리펩티드 사슬이 형성된다. 폴리펩티드 사슬의 질량이 10000U를 초과하고 사슬의 아미노산의 수가 100을 초과하면 단백질로 알려진 것을 얻습니다.
단백질의 구조는 작업을 수행하는 능력에 중요합니다. 단백질이 최종 형태 또는 형태를 달성하는 방법을 이해하기 위해서는 먼저 단백질 구조의 4 단계를 이해해야합니다 :1 차, 2 차, 3 차 구조.
1 차 구조
- 단백질의 주요 구조는 그들의 사슬을 포함하는 아미노산의 정확한 배열로 정의됩니다.
- 단백질의 정확한 서열은 최종 주름에 영향을 미치기 때문에 중요합니다. 결과적으로 단백질이 합성되면 단백질의 기능에 영향을 미치기 때문입니다.
- 단백질은 다수의 폴리펩티드 사슬의 연관성을 통해 형성됩니다. 이들 사슬은 해당 개별 단백질에 특이한 정확한 서열로 구성된 아미노산을 포함한다. 단백질의 서열의 모든 변경은 전체 단백질에 영향을 미칩니다.
폴리펩티드 사슬 내부에 함유 된 아미노산 서열은 단백질의 적절한 기능에 중요하다. 이 서열은 DNA 분자의 유전자 코드로 인코딩된다. 아미노산 서열의 변화를 초래하는 DNA의 돌연변이는 단백질의 기능 능력에 영향을 줄 수있다. 단백질의 폴리펩티드 사슬의 아미노산 서열은 단백질의 주요 구조 요소로서 작용한다. 단백질을 크리스마스 트리 장식품으로 상상하기 위해, 그들의 주요 구조는 다른 형태와 품종의 팝 옥수수가 함께 묶여 크리스마스 트리 화환을 형성하는 순서로 생각할 수 있습니다.
단백질의 1 차 구조는 아미노산 사이에 형성되는 공유 펩티드 결합에 의해 유지된다. 서열화 된 최초의 단백질 인 주요 인슐린 구조.
생화학 자들은 습관의 문제로 폴리펩티드 사슬의 아미노-말단에서 시작되는 아미노산을 자주 나열합니다.
낭포 성 섬유증, 겸상 세포 빈혈, 알비 니즘 등과 같은 알려진 모든 유전자 질환은 1 차 단백질 구조의 변화를 생성하는 돌연변이에 의해 생성되며, 이는 2 차, 3 차 단백질 구조의 변화를 생성합니다.
.아미노산은 키랄 탄소와 4 개의 치환기로 구성된 작은 화학 화합물이며, 이는 함께 결합됩니다. 네 번째 아미노산만이 다른 아미노산과 다른 측쇄를 가지고 있습니다.
단백질의 2 차 구조
단백질의 경우, 2 차 구조는 골격에서 원자들 사이의 상호 작용의 결과로 폴리펩티드 내에서 발생하는 접힌 구조를 나타냅니다.
- 단백질은 일반적으로 믿는 것처럼 폴리펩티드의 단순 사슬로 존재하지 않습니다.
- 펩티드 링크의 아민과 카르복실기 사이의 상호 작용은 일반적으로 이러한 폴리펩티드 사슬의 폴딩을 담당합니다.
- 구조는 긴 폴리펩티드 체인을 찾을 수있는 모양입니다.
- 그들은 나선 구조와 주름 된 시트 구조의 두 가지 주요 구조에서 발생하는 것으로 밝혀졌습니다. 나선 구조는 가장 일반적인 유형의 구조입니다.
- 이 구조는 폴리펩티드 체인의 골격의 정기적 인 폴딩의 결과로 형성되며, 이는 -CO 그룹과 펩티드 링크의 -NH 그룹 사이의 수소 결합으로 인해 발생합니다. .
- 반면에, 단백질 사슬의 일부는 자신의 로컬 폴드를 개발할 수 있으며, 이는 더 단순하고 일반적으로 나선형, 넓은 모양 또는 루프의 모양을 취합니다. 이것은 로컬 폴드라고합니다. 이차 요소는 단백질의 2 차 구조의 형성에 기여하는 국부 주름입니다.
(a) α - 나선 :
나선은 폴리펩티드 사슬이 각 아미노산 잔류 물의 -NH 그룹을 나선의 인접 회전의 -CO로 결합하여 오른 손잡이 나사로 비틀어 가능한 모든 수소 결합을 형성하는 가장 일반적인 방법 중 하나이다. 나선은 폴리펩티드 사슬이 오른 손잡이 나사로 비틀어서 가능한 모든 수소 결합을 형성하는 가장 일반적인 방법 중 하나입니다. 폴리펩티드 사슬은 비틀기의 결과로 오른 손잡이 나사를 형성했습니다.
(b) β - 주름 시트 :
이 구성에서 폴리펩티드 사슬은 서로 옆에 뻗어 나간 분자간 수소 결합에 의해 서로 연결되어 있습니다. 이 구조를 통해, 모든 펩티드 사슬은 서로 위에 쌓이기 전에 거의 최대 연장으로 뻗어 있으며, 이는 분자간 수소 결합에 의해 함께 유지됩니다. 주름진 물고기 주름은 주름이있는 시트의 구조를 연상시키는 것이므로 주름 시트라고 불리는 이유입니다.
단백질의 3 차 구조
- 이 구조는 단백질의 2 차 구조가 더 단단히 접힌 결과로 형성됩니다.
- h- 결합, 정전기력, 이황화 연결 및 Vander Waals는 모두이 결정 구조의 안정성을 유지하기 위해 함께 작동합니다
- 단백질의 3 차 구조는 폴리펩티드 체인의 전체 폴딩과 라인 아래의 2 차 구조의 폴딩을 나타냅니다.
- 그것은 두 가지 1 차 분자 모양의 형성을 담당합니다 :섬유질과 구형.
- 수소 결합, 이황화 결합, van der waals 인력의 힘, 그리고 점점의 정전기력은 단백질의 2 차 및 3 차 구조를 유지하는 데 도움이되는 주요 힘입니다.
단백질의 4 차 구조
4 차 구조에서, 다양한 3 차 구조의 공간 배열은 새로운 구조의 형성을 초래한다. 일부 단백질은 2 개 이상의 폴리펩티드 사슬로 구성되며, 이는 서브 유닛으로 지칭되며, 이는 함께 연결됩니다. quinterary 구조는 서로 관련하여 이들 서브 유닛의 공간 배열을 설명하는 데 사용되는 용어이다. 각각의 단백질의 정확한 아미노산 서열은 과학계에서 3 차 구조라고하는 고유하고 생물학적으로 활성 3 차원 접힘 자체로 접히도록 유발한다. 2 차 요소의 다양한 조합은 단백질을 구성하며, 그 중 일부는 단순하고 다른 하나는 조성물에서 더 복잡한 것입니다. 단백질의 경우, 도메인은 자체 3 차원 폴드를 갖고 특정 기능에 할당 될 수있는 단백질 사슬의 세그먼트이다. 이들은 현재 진화와 기능 측면에서 단백질의 구조적 및 기능적 빌딩 블록으로 간주됩니다.
대부분의 효소 인 많은 단백질은 물의 존재 하에서 활성 및 안정성에 필요한 유기 또는 무기 성분을 함유한다. 결과적으로, 단백질 진화에 대한 연구는 구조적 지식을 제공 할뿐만 아니라 신진 대사의 다양한 섹션에서 단백질을 연결하는 역할을합니다.
결론
단백질은 아미노산의 사슬로 구성되며, 이후에는 특정 3 차원 구성으로 접 힙니다. 단백질 분자 내에서 결합의 형성은 그들의 구조의 안정화를 돕고, 최종 접힌 형태의 단백질은 각각의 역할에 적합하다. 개별 단백질은 특정 모양과 구조로 구별됩니다. 단백질은 인간 존재를 유지하고 지원하기 위해 복잡하고 조정 된 방식으로 협력합니다. 다시 말해서, 단백질의 기능을 이해하면“생명이란 무엇입니까?”라는 질문에 대한 단서를 제공 할 수 있습니다. 그리고 그들의 구조를 면밀히 검사하면 그들이 어떻게 기능하는지 보여줄 수 있습니다.