핵심 개념
Quantum 번호 에 대한이 자습서에서 , 당신은 우리가 관련 원자에서 전자의 특성을 설명 할 수있는 방법을 배웁니다. 이러한 다양한 특성에는 에너지 수준, 모양, 방향 및 스핀이 포함됩니다. 궤도 모양 에 대해서도 배울 것입니다 .
어휘
노드 =제로 전자 밀도의 점 또는 평면
양자 번호 소개 &궤도 모양
양자 수는 원자 궤도, 전자를 찾을 수있는 공간의 영역을 설명하는 데 사용됩니다. 이 숫자로부터, 우리는 원자 궤도에서 전자의 다른 특성을 결정할 수 있습니다. Pauli 배제 원칙에 따라 각 전자는 다른 전자가 다른 전자에 고유 할 것이라는 점에 유의해야합니다. 이것이 사실이 되려면, 같은 원자의 두 전자가 동일한 4 개의 양자 수를 가질 수 없습니다.
주요 양자 수 ( n )
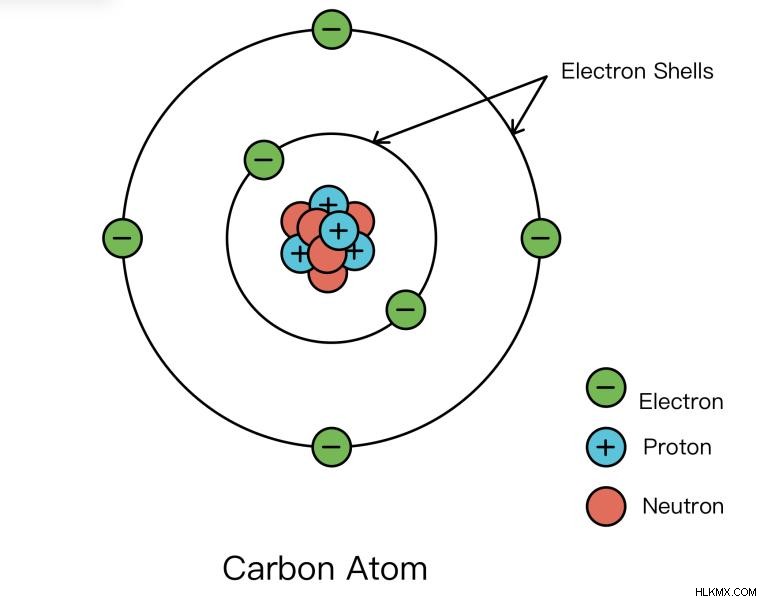
주요 양자 수 ( n )는 궤도의 전자 쉘 또는 크기를 설명합니다. 전자 쉘은 전자가 핵을 공전하는 원자의 일부로 생각할 수 있습니다. 러더 포드가 핵을 어떻게 발견했는지 알아보십시오.
n 의 유일한 허용 값 1부터 시작하는 정수 정수입니다. 더 높은 n 값은 관련된 전자가 핵에서 멀리 떨어져 있음을 의미합니다. 예를 들어, n 가있는 전자 =1은 n 인 전자보다 핵에 훨씬 더 가깝습니다. =5. 전자를 동일한 l 과 비교할 때 , 우리는 또한 더 높은 n 가있는 전자라고 말할 수 있습니다. 가치는 더 높은 에너지입니다. 더 높은 n , 전자는 더 먼 거리로 인해 양의 차전 된 핵의 매력적인 당김을 느끼지 않습니다. 전자의 음전하가 안정화되지 않으므로 전자는 더 높은 에너지입니다.
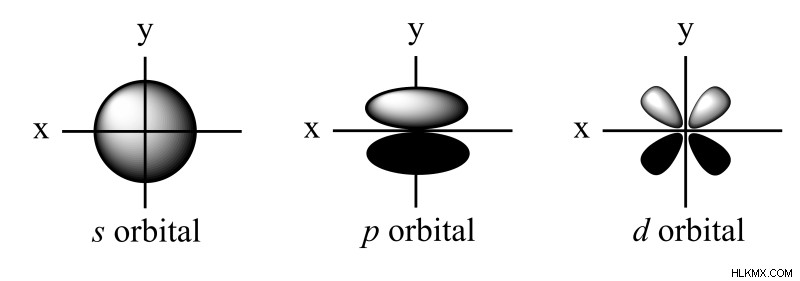
궤도 모양 - 각 운동량 양자 수 ( l )
4 가지 종류의 궤도에는 S, P, D 및 F 궤도입니다. 그들은 각각 다른 궤도 모양을 가지고 있습니다. S- 궤도는 중앙의 핵과 구형입니다. p- 궤도는 아령 모양이며 5 개의 d- 궤도 중 4 개는 클로버 잎 모양입니다. 마지막 D- 궤도는 중앙 주위에 도넛이있는 길쭉한 아령입니다.
각 운동량 양자 수 ( l )는 궤도의 서브 쉘 또는 모양을 설명하며 허용 범위는 (0,…, n 입니다. - 1). 기억해야 할 네 가지 모양이 있습니다 :S, P, D 및 F 궤도. l 의 값 각 서브 쉘에 할당 된 것은 각도 노드 (평면)의 수를 기준으로합니다. 구체 인 S orbitals의 경우 각도 노드가 없으므로 l =0. P Orbitals의 경우 하나의 각진 노드로 분리 된 전자 밀도, l =1.이 추세에 따라 D 궤도는 l 을 가질 것입니다. =2 및 f 궤도는 l 을 가질 것이다 =3, 각각 2 개와 3 개의 각도 노드가 있으므로
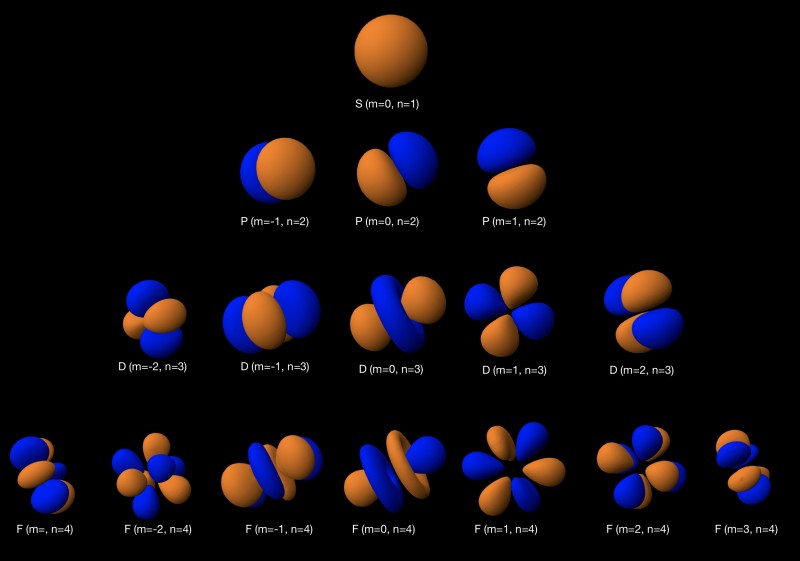
자기 양자 수 ( m l )
자기 양자 수 ( m l )는 3D 공간에서 서브 쉘의 다양한 방향을 설명합니다. 그 범위는 (- l 입니다 ,…, l ), 특정 모양을 고유하게 회전시킬 수있는 방법에 대해, 가능한 많은 m
스핀 양자 번호 ( m s )
스핀 양자 수 ( m s )는 궤도에서 특정 전자의 스핀을 설명합니다. 스핀은 +/- ½이며, 이는 상향 스핀 또는 다운 스핀을 나타냅니다. 각 궤도는 최대 2 개의 전자를 유지할 수 있으며, 완전히 채워지면 전자는 동일한 스핀 방향을 공유 할 수 없습니다. 전자가 반대 방향을 가리키지 않으면 Pauli 배제 원칙을 위반하는 것입니다. 두 개의 전자는 동일한 4 개의 양자 수를 공유 할 수 없습니다. 궤도가 완전히 점유되지 않으면 전자는 스핀 방향을 취할 수 있습니다. 컨벤션은 일반적으로 위로 스핀을 먼저 할당하지 않습니다.
ChemTalk
에서 자세히 알아보십시오이름 지정 알칸스
분자식 대 경험적 공식
명명 이온 성 화합물