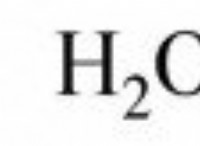반응 속도에 영향을 미치는 다양한 요인이 있습니다. 이러한 요인에는 결합의 성질, 열역학, 동역학 및 이들이 존재하는 물리적 상태, 온도, 압력, 농도, 촉매의 존재 또는 부재 등과 같은 물리적 요인과 같은 반응물의 화학적 요인이 포함됩니다. 균형 잡힌 반응을 겪기 위해, 반응물의 화학적 인자와 반응물의 물리적 상태는 동일한 고려가 필요하다.
반응이 발생하기 위해서는 반응물이 서로 접촉하는 것이 매우 중요합니다. 반응물이 다른상에있는 경우 인터페이스에서만 서로 반응합니다. 완전한 반응이 발생하기 위해서는 참여 반응물의 특성을 알아야합니다.
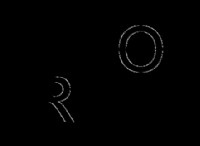
화학 반응을 나타낼 때 반응물의 물리적 상태를 언급하는 것이 중요합니다. 이를 통해 독자는 반응물의 상, 적용 압력 및 온도, 반응에서의 촉매의 역할 및 기타 기본 매개 변수를 이해하도록합니다. 대부분의 반응에서, 고체의 경우 (L), 액체의 경우 (L), 가스의 경우 (g) 및 수성 배지의 경우 (aq)과 같은 일반적인 표기법이 언급된다. 이들은 반응의 단계를 나타냅니다. 이 외에도, 온도, 압력 및 촉매 정보는 제품으로 향하는 화살표에 언급된다. 반응이 가역적이고 양방향으로 진행될 수 있다면, 반 화살촉 (⇌) 2 개가 사용되는 반면 반응이 돌이킬 수없고 한 방향, 즉 순방향으로 만 진행되는 경우, 제품으로 향하는 단일 화살표 (→)가 사용됩니다.
반응물의 물리적 상태를 설명하는 데 사용되는 표기법
|
기호/표기법
|
의미
|
|
s
|
단단한
|
|
l
|
액체
|
|
g
|
가스
|
|
aq
|
수성
|
|
ppt
|
침전물
|
|
Δ
|
열
|
|
t
|
정도/켈빈의 온도
|
| ↑ |
열/가스는 시스템에서 진화합니다 |
반응에 영향을 미치는 물리적 요인
반응물의 온도
반응의 온도가 증가하면 일반적으로 반응이 더 빨리 발생합니다. 실험실에서 오븐, 버너 및 핫 플레이트를 사용하여 반응 속도를 높였을 수도 있습니다. 반면, 붕괴 과정이 느려짐에 따라 냉장고에 보관 된 음식의 저장 수명이 증가합니다. 반응 온도가 증가하면 반응 속도가 두 배가됩니다.
반응물의 농도
반응의 농도는 반응 속도에 직접 비례한다. 반응물 농도가 두 배가되면 반응이 더 빨리 발생합니다. 예를 들어, 탄산 칼슘은 이산화황의 존재하에 빠르게 악화됩니다. 공기 중 이산화황의 농도가 증가함에 따라, 열화가 발생하는 탄산 칼슘의 양은 두 배가된다. 다음 반응을 고려하십시오.
이 반응에 사용 된 황산은 습기와 반응하여 황산을 형성하는 이산화염에서 나온 것입니다.

촉매
반응 속도를 증가 시키거나 반응에서 소비하지 않고 반응에 필요한 온도 또는 압력을 낮추는 물질을 촉매라고합니다. 촉매의 존재는 반응 속도를 높이는 데 중요한 역할을한다. 다음 반응을 고려하십시오.

상기 반응에서, 염화 칼륨으로 염소산 칼륨의 감소는 산화 망간의 존재로 인해 더 빠릅니다. 우리가 반응을 관찰하면 반응의 끝에서 촉매가 유지되어 긍정적 인 촉매임을 나타냅니다.
반응물의 표면적
표면적은 더 빠른 반응에 도움이되는 또 다른 중요한 매개 변수입니다. 반응의 속도에 직접 비례합니다. 예를 들어, 고체 및 가스 반응물이 서로 혼합 된 경우, 고체의 표면 분자만이 코어에 존재하는 분자가 아닌 가스 분자와 상호 작용할 것이다. 그러나 평평한 표면에 동일한 고체가 퍼지면 더 많은 분자가 가스와 상호 작용할 것입니다.
결론
반응이 발생하는 것으로 간주되는 다양한 요인이 있지만, 반응물의 물리적 상태는 반응이 진행되는 속도를 결정하는데 중요한 역할을한다. 이 섹션에서는 온도, 촉매, 농도 및 표면적과 같은 이러한 요인 중 일부가 논의되었습니다.