분자에서 결합의 동등한 특성을 설명하기 위해 Pauling에 의해 하이브리드 화를 처음으로 도입했습니다. 또한 상이한 모양과 에너지의 상이한 형상과 원자 궤도의 조합과 동일한 모양과 에너지를 갖는 새로운 궤도를 확립하기 위해 에너지의 재분배로 설명 될 수있다. 이 새로운 궤도는 하이브리드 궤도라고하며, 현상은 하이브리드 화라고합니다. 이 기사에서는 브롬 트리 플루오 라이드의 혼성화를 통해 브롬 트리 플루오 라이드의 혼성화에 대해 배울 것입니다.
brf3
브로민 트리 플루오 라이드 또는 Brf3는 삽입 된 화합물입니다. 이 분자는 하나의 브로민과 3 개의 불소 원자를 함유한다. 분자의 이러한 모든 원자는 높은 전기 음성 값을 갖는다.
brf3는 강한 냄새와 밀짚 색의 액체의 모양을 갖습니다. 본질적으로, BRF3 (브롬 트리 플루오 라이드)은 극성 분자이다. 왜냐하면 브롬 원자에 2 개의 고독한 쌍이 존재하면 분자의 형태가 변형되거나 구부러지기 때문이다. Brf3 분자는 브롬과 3 개의 불소 원자 사이의 전하 분포가 균일하지 않기 때문에 극성이다.
Paul Lebeau는 1906 년에 처음 으로이 화합물을 20 ° C에서 불소와 반응 하여이 화합물을 합성합니다. 다음 방정식은 반응을 나타냅니다.
br2 + 3f2 → 2brf3
브롬 트리 플루오 라이드는 또한 브롬 모노 플루오 라이드를 동시에 감소시키고 산화시킴으로써 생성 될 수있다. 브롬 트리 플루오 라이드와 브로 민은이 반응의 결과로 형성됩니다.
3brf → brf3 + br2
BRF3의 특성
-
이 물질의 단일 소스 덩어리는 135.913547 u입니다. (통합 원자 질량 단위).
-
브롬 트리 플루오 라이드는 136.90 g/mol의 몰 질량 을가집니다.
-
높은 hygroscopicity가있는 액체입니다.
-
브롬 트리 플루오 라이드는 136.90 g/mol의 몰 질량 을가집니다.
-
이 물질은 분자 쌍극자 모멘트가 1.19 Debye입니다.
-
물질의 밀도는 2.803 g/cm3입니다.
-
이 물질의 끓는점은 125.72 ° C입니다.
-
액체는 자동 이온화로 인해 전기의 우수한 도체입니다.
-
매우 부식성 액체입니다.
-
68.0 ° F 온도에서 브롬 트리 플루오 라이드의 비중은 2.81입니다.
-
이 물질은 분자 쌍극자 모멘트가 1.19 Debye입니다.
브롬 트리 플루오 라이드의 혼성화
브롬 트리 플루오 라이드의 하이브리드 화를 평가하기 위해 먼저 중앙 원자, 브롬의 전자 구성을 조사 할 것입니다. 다음과 같이 작성되었습니다.
1S²2S²2P⁶3S²3p⁶3d¹⁰4S²4p⁵
그러나, 브롬의 일부 전자는 불소 원자와 결합을 형성하기 위해 4D- 궤도로 재배치된다. 또한 불소는 산화 능력이 높기 때문에 브롬은 전자를 상기 수준으로 촉진하도록 강요한다. Bromine은 이제 d- 궤도를 사용하여 혼성화 할 수 있습니다.
가장 바깥 쪽 쉘에서 BRF3에는 7 개의 전자가 있습니다. 또한 결합이 형성된 후 2 개의 고독한 쌍과 3 개의 Br -f 공유 결합이 있습니다. 전자 쌍의 하이브리드 화 값은 5와 같기 때문에 SP3D 하이브리드 궤도가 형성됩니다.
BRF3의 구조
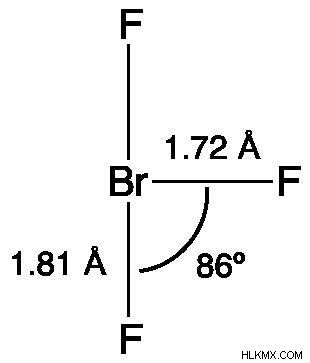
Bromine trifluoride의 Lewis 구조는 그것이 T 자형 분자 구조를 가지고 있음을 보여준다. 중심 브롬은 분자 형성의 VSEPR 이론에 따라 2 개의 전자 쌍과 관련이있다. 브로민 센터와 적도 불소 사이의 거리는 1.72Å이며 브롬 중심과 각 축 방향 불소 사이의 거리는 1.81Å입니다. 86.2 °는 적도 불소 및 축 불소에 의해 형성된 각도입니다. BR-F 결합으로부터의 반발 압력은 전자 쌍의 힘보다 작기 때문에 각도는 90 °보다 약간 작다.
BRF3의 극성
-
BRF3 분자는 비극성으로 분류됩니다.
-
BR과 F 원자 사이의 전기 음성 성의 큰 차이로 인해. 전하는 분자 전체에 균일하게 분포되지 않습니다.
-
Bromine 원자의 고독한 쌍으로 인해 Brf3의 모양은 비대칭이며, 이는 불균일 한 전하 분포에도 기여합니다.
-
그러한 비극성 분자는 0이 아닌 순 쌍극자 모멘트가 있습니다.
BRF3의 모드
분자 궤도 다이어그램을 사용하여 분자에서 전자의 위치와 거동을 설명 할 수 있습니다. 원자가 전자 쌍과의 고독한 쌍 결합의 형성은 분자의 물리적 특성에 영향을 미친다. 이 기능은 이러한 형태의 결합이있을 때 특정 영역에서 전자를 찾아 혼성화의 모양을 식별합니다.
Mo 이론은 전자 쌍의 에너지 및 공간적 특성과 관련이 있습니다. 또한 분자 궤도를 형성하기 위해 원자 궤도가 선형으로 결합되는 방법에 대해서도 논의합니다.
BRF3의 공식을 작성하는 방법?
BRF3 분자에 몇 개의 원자가 전자가 있습니까? BR과 F는주기적인 테이블 그룹 7의 halogen입니다.
결과적 으로이 두 요소는 모두 7입니다. BRF3의 총 원자가 전자 수
=7 + 7*3
=7 + 21
=28.
어떤 원자가 이제 중앙 원자로 작용합니까?
우리는 중앙에서 가장 전기 음성 요소를 일반적인 규칙으로 유지합니다. 전기 음성도 차트에 따르면, 브롬은 전기 음성 값이 2.96이고 F의 값은 3.98입니다. 이제 우리는 원자 주위에 28 개의 원자가 전자를 감아 낙지를 완성합니다. 이 시스템의 모든 원자에는 이제 옥켓 구성이 있습니다. 3 개의 F 원자 및 Br 원자 각각.
이것이 BRF3의 가장 좋은 루이스 구조 형성인지 여부를 결정하려면 먼저 다른 개념 인 공식 요금을 이해해야합니다. 결합이 존재하는 모든 원자들 사이에서 결합이 동일하게 공유 될 때 화학 분자 내에서 구성 원자에 할당 된 전하는 공식 전하라고합니다.
루이스 구조를 형성하려면 먼저 모든 원자가 가능한 공식 전하 값이 가장 낮은 지 여부를 결정해야합니다.
brf3 :
의 수학을 해보자공식 전하 =7- 0.5* 2 -6 =0
br :공식 전하 =7-0.5*6-4 =0
우리는 3 개의 f 원자와 단일 BR 원자의 공식 전하 값이 모두 0임을 알 수 있습니다. 결과적으로, 우리는 이미 가장 적절한 LS 다이어그램을 얻었다는 결론을 내릴 수 있습니다.
결론
이 기사는 브롬 트리 플루오 라이드 노트의 혼성화를 통해 브롬 트리 플루오 라이드의 혼성화를 설명합니다. Brf3의 혼성화는 Sp³d이고 그 구조는 T 자형 또는 삼각형 bipyramidal이다. 브롬 트리 플루오 라이드는 비극성 분자이다. 위의 상장 단계를 통해 BRF3의 공식을 쓸 수 있습니다.