이중 결합은 두 쌍의 전자가 두 원자 사이에 공유되는 화학적 결합입니다. 이러한 유형의 결합은 일반적으로 단일 결합에 관여하는 2 개의 결합 전자 대신 원자 사이에 4 개의 결합 전자를 포함한다. 이중 결합은 다수의 전자로 인해 반응성이있는 경향이 있습니다. 이중 채권은 단일 결합보다 물리적으로 짧고 비교적 강합니다. 이중 결합은 화학 구조 다이어그램에서 두 개의 평행선으로 그려집니다. 동일한 부호는 공식에서 이중 결합을 나타내는 데 사용됩니다. 러시아 화학자 알렉산더 버틀러 로프 (Alexander Butlerov)는 19 세기 중반에 구조 공식에 이중 채권을 도입했습니다. 이 기사는 이중 채권에 대한 개요를 제공합니다.
이중 채권의 정의
더 많이 공유할수록 더 강해지는 것은 비밀이 아닙니다. 최소한 원자이고 전자를 공유한다면 사실입니다! 원자는 최대 3 세트의 전자를 공유 할 수 있습니다. 두 개의 원자가 두 쌍의 전자를 공유 할 때 이중 결합이 형성됩니다.
전자는 항상 쌍으로 공유됩니다. 각 공유 전자 쌍을 공유 결합이라고합니다. 2 개의 공유 전자는 공유 결합에 해당합니다. 두 개의 공유 전자의 두 세트는 하나의 공유 이중 결합과 같습니다. 총 4 개의 전자가 2 개의 평행선으로 표시되는 이중 결합으로 공유됩니다.
이중 결합의 두 원자는 4 개의 전자를 공유하기 때문에 단일 결합에 의해 결합 된 원자에 필요한 것보다 결합 된 원자를 분리하기 위해 더 많은 에너지가 필요합니다. 산소 원자 사이의 이중 결합을 깨는 데 필요한 에너지는 산소 원자 사이의 단일 결합을 깨는 데 필요한 에너지의 3 배입니다. 질소도 마찬가지입니다. 이중 결합을 강하게 만드는 메커니즘은 또한 더 짧게 만듭니다. 이중 결합 탄소의 다른 탄소 원자에 대한 평균 결합 길이는 2 개의 단일 결합 탄소의 평균 결합 길이보다 13% 낮습니다.
이중 결합 형성
2 개의 원자가 4 개의 전자를 공유하기 위해 4 개의 전자를 공유해야 할 때 이중 결합이 형성됩니다. 옥트 규칙에 따르면, 원자가 8 개의 원자가 전자를 갖도록 전자를 잃거나, 얻거나 공유 할 것입니다. 이중 결합은 종종 본질적으로 형성되며 일반적으로 탄소, 질소 및 산소와 같은 비금속으로 만들어집니다. 이중 결합이 어떻게 형성되는지 이해하려면 전자에 어떤 일이 일어나는지, 본드의 빌딩 블록을 살펴 보겠습니다.
전자는 원자 주위에서 불규칙하고 빠르게 움직입니다. 전자의 에너지 수준과 핵에 근접하여 전자는 특정 형태로 유지됩니다. 전자가 차지하는 특정 모양을 전자 궤도라고합니다. 전자 궤도에는 4 가지 형태의 전자 궤도가 있습니다 :s, p, d 및 f. 이중 결합에는 S와 P 궤도가 포함됩니다.
일부 원자는 더 많은 전자를 포기하여 이중 결합을 형성 할 수있는 반면, 다른 원자는 더 적은 결합을 포기할 수 있습니다. 원자가 가져 오는 원자가 4 개의 전자를 공유하기 위해 사용 가능한 전자 주위를 움직여야합니다.
각 원자는 먼저 SP 궤도를 형성하기 위해 가장 바깥 쪽 궤도를 p 궤도와 병합해야합니다. 이 하이브리드 궤도에는 2 개의 전자가 포함됩니다. 각 원자의 SP 궤도는 겹치므로 각 원자는 두 전자에 액세스 할 수 있습니다. 이러한 채권을 시그마 채권이라고합니다. 각 원자는 나머지 2 개의 P 궤도 중 하나를 사용하여 다른 원자와 2 개의 전자를 공유합니다. 중첩 된 p 궤도에서 공유되는 전자를 PI 결합이라고합니다. 이중 결합은 하나의 σ 결합과 하나의 π 결합을 나타냅니다.
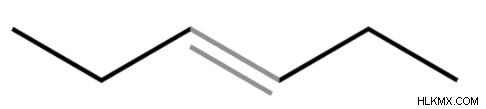
이중 채권의 예
에틸렌 (C2H4)은 2 개의 탄소 원자 사이에 이중 결합을 갖는 탄화수소이다. 다른 올레핀은 또한 이중 결합을 함유한다. 이중 결합은 이민 (C =N), 설폭 사이드 (S =O) 및 AZO 화합물 (n =N)에서 관찰됩니다.
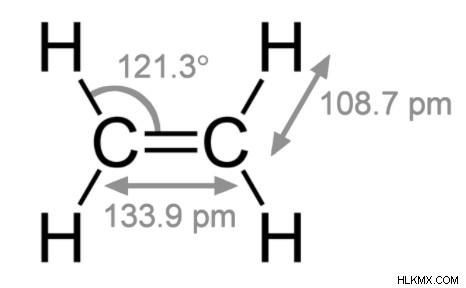
단일, 이중 및 트리플 본드의 차이는 다음과 같습니다.
-
정의 :
단일 본드 :단일 본드는 한 쌍의 원자가 전자를 공유하여 발생합니다.
이중 결합 :이중 결합은 두 쌍의 원자가 전자를 공유하여 발생합니다.
트리플 본드 :트리플 본드는 3 쌍의 원자가 전자를 공유하여 발생합니다.
-
반응성 :
단일 본드 :단일 본드는 덜 반응합니다.
이중 결합 :이중 결합은 적당히 반응합니다.
트리플 본드 :세 가지 키는 매우 칙칙합니다.
-
바인딩 길이 :
단일 본드 :단일 채권의 결합 길이가 높습니다.
이중 결합 :이중 채권은 평균 결합 길이입니다.
트리플 본드 :트리플 본드의 결합 강도는 낮습니다.
-
디자이터 :
단일 본드 :단일 키는 단일 대시 (CC)로 표시됩니다.
이중 결합 :이중 결합은 2 개의 평행 대시 (c =c)로 표시됩니다.
트리플 본드 :트리플 본드는 3 개의 병렬 대시 (C≡C)로 표시됩니다.
예 :
-
단일 본드 :예를 들어, 메탄, 에탄, 프로판, 부탄 등과 같은 알칸
-
이중 결합 :예 :에틸렌, 프로필렌, 카르 보닐 (C =O), 아조 화합물 (n =N), 이민 (C =N) 및 설폭 사이드 (S =O).
-
트리플 결합 :예 :질소 (N≡N), 시안화물 이온 (C≡N), 아세틸렌 (CH≡CH) 및 일산화탄소 (C≡O).
결론
일반적인 전자 쌍이 아닌 두 개의 전자 쌍이 두 개의 원자 사이에서 공유되는 공유 결합, 가장 일반적으로 탄소와 탄소, 산소 또는 질소 원자 사이에서 공유되지만 다른 형태는 알려져 있습니다. 이중 결합은 이들을 연결하는 원자에 관계없이 하나의 시그마 결합과 하나의 PI 결합으로 구성됩니다. 이중 결합에 대한 이러한 궤도 관점은 유기 화합물 에서이 수준에서만 중요합니다. 그것에 대해 자세히 알아 보려면 아래의 첫 번째 링크를 클릭하면 유기농 링크 전용 섹션이있는 메뉴로 이동합니다. 에틸렌에 대한 반복적 인 설명을 찾을 수 있지만 벤젠 및 탄소 산소 이중 결합의 결합에 대한 정보도 찾을 수 있습니다.
.