실온에서 디보 레인은 불쾌하고 달콤한 냄새가 나는 무색 가스입니다. 공기와 혼합 될 때 폭발성 조합을 쉽게 생성합니다. 실온에서, 디보 레인은 촉촉한 공기에서 자발적으로 점화됩니다. 디보 레인은 환원제, 고무 가상 카이저, 탄화수소 중합을위한 촉매, 화염 속도 가속기 및 로켓 추진제의 도핑 제로서 사용된다. 또한 전자 장치에서 순수한 결정 전기 특성을 제공하는 데 사용됩니다.
물은 수소 가스, 휘발성 가스 및 붕산, 통제되지 않은 물질을 분해합니다. 증기는 공기보다 무겁습니다. 낮은 수준에 장기간 노출되거나 고농도에 대한 단기 노출 후,이 증기의 흡입은 건강에 악영향을 미칠 수 있습니다. 전자 재료에도 사용됩니다.
모두 Diborane
디보 레인의 제조
우리는 붕소로 금속 수 소화물의 작용으로 디보 레인을 준비 할 수 있습니다. 이 프로세스는 산업 생산에 사용됩니다. 요오드와 나트륨 보로 하이드 라이드와의 반응에 의해 소량으로 디보 레인을 얻으려면 diglyme가 필요하다.
.
특성
보란은 본질적으로 무색이며 열 안정성이 낮은 디아마그성 화합물입니다. 디보 레인은 실온에서 매우 유독 한 달콤한 냄새 가스 가스입니다. 또한 매우 반응이 좋습니다. 고온에서 더 높은 보란을 생성하여 수소를 방출합니다.
Diborane은 물과 알칼리와 반응하여 붕산과 대사를 제공합니다.

수경화
실온에서, 디보 레인은 에테르 용매에서 알켄 및 알킨과 결합된다. Hydroboration은 합성 유기 화학에 일반적으로 사용되는 반응입니다. 
공기의 행동
순수한 디보 레인은 실온에서 공기 또는 산소와 반응하지 않지만 불순한 형태로 많은 양의 열과 함께 B2O3을 제공합니다.

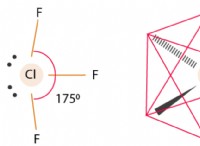
디보 레인의 구조
2 개의 브리징 하이드로겐은 디보 레인에서 2 개의 BH2 단위를 연결합니다. 따라서 8 개의 B-H 결합이 있습니다. 반면에, 디보 란에는 12 개의 원자가 전자가 있으며, 이는 정기적 인 공유 결합을 생성하기에 충분하지 않습니다. 정상 공유 결합은 4- 말단 B-H 결합 (2 개의 중심-2- 전자 결합 또는 2C-2E 결합)을 구성합니다. 브리징 채권에는 나머지 4 개의 전자가 필요합니다. 2 개의 3 중심 B-H-B 결합 각각에 2 개의 전자가 사용된다. 결과적으로, 이들은 3- 센터-전자 결합 (3C-2E)이다. 디보 레인의 붕소는 SP3 하이브리드 화된다.
4 개의 SP3 하이브리드 화 궤도 중 3 개는 단일 전자를 함유하고, 네 번째 궤도는 비어 있습니다. 각 붕소에는 2 개의 반으로 채워진 하이브리드 화 된 궤도가 있으며, 이는 2 개의 수소와 겹쳐서 4 개의 말단 2C-2E 결합을 생성하여 하나의 빈과 반으로 채워진 하이브리드 화 궤도를 남깁니다. B-H-B 결합은 하나의 붕소의 반으로 채워진 하이브리드 화 궤도, 다른 붕소의 빈 혼성 궤도, 반으로 채워진 1S 수소 궤도를 겹쳐서 형성합니다.
본딩
디보 레인은 4 개의 말단 수소 원자와 2 개의 브리징 수소 원자를 갖는 D2H 구조를 갖는다. 분자 궤도 이론 모델에 따르면, 붕소와 말단 수소 원자 사이의 연결은 표준 2centre-2 전자 공유 결합이다. 그러나, 탄화수소 화합물과 달리, 붕소 원자와 브리징 수소 원자 사이의 관계는 다르다.
각각의 붕소는 2 개의 전자를 갖는 말단 수소 원자에 부착 한 후 추가 결합을 위해 1 개의 원자가 전자를 갖는다. 브리징 수소 원자 각각은 하나의 전자를 기여합니다. 결과적으로, 4 개의 전자는 B2H2 고리를 함께 유지하는데, 이는 3centre-2 electron 결합의 예이다. 이 형태의 채권은 때때로 '바나나 본드'라고 불립니다.
본딩
디보 레인 및 이의 유도체는 수평선을위한 중요한 유기 합성 시약이며, 이는 B-H 결합에 걸쳐 알켄을 첨가하여 시험 마일 보란을 생성하는 것을 포함한다. 디보 레인은 리튬 알루미늄 수 소화물과 유사한 반응성을 갖는 환원제로서 이용된다. 분자는 카르 복실 산을 알코올로 빠르게 전환시키는 반면, 케톤은 출발 물질로 산과 천천히 반응합니다.
.디보 레인의 사용
- Diborane은 에너지 밀도가 높은 추진제로 사용됩니다.
- 유기 화학에서는 환원제로 사용됩니다.
- 용접 횃불에 사용됩니다.
결론
가장 전형적인 반응 패턴 중 하나는 Lewis베이스와 부가 물의 형성입니다. 이러한 초기 부가 물은 종종 다른 제품을 생산하기 위해 신속하게 개발합니다. 예를 들어 Borane-Tetrahydrofuran은 일반적으로 디보 레인 대체물로 사용되는 Borate 에스테르로 분해됩니다. 디메틸 황화물 부가 물은 중요한 화학 시약입니다. 암모니아 디포 레인은 암모니아 보란과 결합되어 조건에 따라 디보 레인 또는 DADB의 디포 니트를 생성합니다.