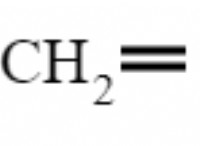산화성 또는 환원 가능한 분석 물의 경우, 산화 환원 적정이 사용될 수있다. 이 접근법은 와인의 SO2의 양을 결정하는 것부터 소독제 용액에서 과산화수소의 양을 결정하는 것까지 다양한 것들에 사용될 수 있습니다. 칼륨 과망간산염의 높은 산화 효과는 망간 산화 환원 적정에서 분석 물을 산화시키기 위해 사용된다. 밝기 때문에 등가 지점을 시각적으로 감지하기 위해 표시기가 필요하지 않습니다.
칼륨 과망간산염 방법은 과산화수소 농도를 검출하는 데 널리 사용됩니다. 최초의 영구 핑크 색상은 가중 샘플이 산성화되고 표준 칼륨 피망산산산염액으로 적어도 몇 분 동안 적정 될 때 발생합니다.
5 H2O2 + 3 H2SO4 + 2 KMNO4-> K2SO4 + 2 MNSO4 + 8 H2O + 5 O2
과망간산 칼륨을 감소시키는 유기 또는 무기물이 존재하는 경우이 절차를 사용할 수 없습니다. 과망간산 에이트는 또한 염화물 이온을 염화물로 산화시켜 적정 오류를 유발할 수 있기 때문에 염산 또는 다른 염화 이온을 사용하지 마십시오. 불소 이온은 과망간산염 적정을 손상시키고, 고농도의 칼슘 염 또는 타이타닉 산이 결과가 좋지 않습니다.
과산화수소의 농도를 결정하는 방법을 찾고 있다면 자세히 논의 해 봅시다.
장비
- Burette (50 ml)
- 0.1 mg 해상도를 가진 분석 균형
- 눈을위한 드롭퍼
- erlenmeyer flasks, 250 ml
- vial 크기 :28 mm OD x 57 mm 높이
시약
탈신 또는 증류 된 물
- 칼륨 과망간산염 (0.10n kmno4)은 1 차 표준으로 옥살 레이트 나트륨과 비교 될 수 있습니다.
- 황산, 1 :4 vol/vol (사전 혼합 및 냉각)
- hno3 (1 :1)
절차
유리 제품 준비
- 신선한 아이 드롭퍼와 무게의 바이알 만 사용하십시오.
- 새로운 플라스크는 밤새 실온에서 1 :1 HNO3으로 처리 한 다음 물로 6 ~ 8 회 헹구어 야합니다.
- 과산화수소 시험의 농도에 사용되는 유리 제품은 크롬산 세정 용액으로 세척해서는 안됩니다. 과산화물을 분해하기 위해서는 미량 크롬 이온이 양호한 촉매제이지만 유리 제품에서 제거하기가 매우 어렵습니다.
과산화수소 샘플의 제조
- 250 ml Erlenmeyer 플라스크에서 약 100ml의 물을 부어 넣으십시오.
- 10 ml 황산 (1 :4 vol/vol)
- 약 1mL의 과산화수소로 일반 아이 드롭퍼를 채우십시오. 시편 바이알에 떨어 뜨리면 낙하산을 놓으십시오.
- 바이알, 드롭퍼 및 과산화수소 샘플을 (0.0002) g로 무게를두고 중량을 기록하십시오.
- 바이알, re-weigh의 드롭퍼를 교체하고 가능한 빨리 새로운 무게를 기록하십시오.
- 바이알, 아이 에디 로퍼 및 샘플의 궁극적 인 무게는 초기 중량에서 빼게됩니다.
적정
지속적으로 교반하는 동안 0.10n kmno4로 적정. 적정이 분수 낙하 증분으로 계속 될 때까지 엔드 포인트가 다가올 때 kmno4를 적게 첨가하십시오. 30 초 동안 지속되는 첫 번째 거의 보이는 핑크색은 엔드 포인트입니다.
0.01 ml에서 사용 된 KMNO4 용액의 부피를 추정하고 기록합니다. 20 ° C에서 5 ° C 온도 차이마다 0.1 %의 부피 조정 계수를 적용하십시오.
.다음 공식을 사용하여 과산화수소의 농도를 계산하십시오.
(ML X N X 0.01701 X 100) / (% H2O2) (샘플 중량)
원리
코발트 이온은 H2O2와 결합하여 화려한 퍼 옥소-코발트 복합체를 형성한다. 샘플의 260 nm 광 흡광도는 표준 H2O2 용액 생성 기준 곡선과 비교됩니다.
응용 프로그램의 범위
식품 가공 및 식수 산업에서 새로운 H2O2 응용에 잔류 H2O2 내지 0.1 mg/L의 정확한 측정이 필요합니다. 이 접근법은 물 매트릭스가 깨끗하고 탁한 이와 유사한 상황에서 잘 작동합니다. 0.2 mg/L 이상을 함유하는 샘플은 증류수 로이 절차에 수용 가능한 농도로 희석 될 수 있습니다.
간섭
바이 설 파이트와 같은 화학 물질을 감소시키는 것은 (유리 H2O2와 반응하는 데 오랜 시간이 걸릴 수 있음) 공동 H2O2 복합체와 빠르게 반응하여 부정적인 판독 값을 오도 할 수 있습니다. 또한 260 nm에서 자외선을 흡수하는 오염 물질은이 방법의 정확성과 감도에 영향을 줄 수 있습니다.
안전을위한예방 조치
코발트 소금은 오래 지속되는 오염 물질로 환경으로 방출해서는 안됩니다. 사용 된 솔루션은 규정에 따라 수집 및 폐기해야합니다.
황산 농축액은 MSD에 따라 처리 및 폐기 해야하는 가성 및 위험한 화학 물질입니다. 진공 후드 아래에서 작업하고 네오프렌 장갑과 모노 고글을 착용하는 것이 제안됩니다.
H2O2 샘플 병을 밀봉해서는 안됩니다. 대신, 알루미늄 호일 또는 파라핀 필름으로 느슨하게 배출되거나 덮어야합니다.
결론
그래서 그것은 과산화수소의 농도를 결정하는 방법에 대한 랩입니다.
과산화수소는 산소와 물만 생산하기 때문에 광범위한 응용 및 산업에서 사용됩니다. 이는 환경에 좋습니다. 그러나 H2O2는 비교적 불안정한 분자이므로 올바른 농도를 유지해야합니다.
적정은 과산화수소의 농도를 결정하는 데 사용할 수있는 많은 절차 중 하나입니다. 그러나 대부분의 사람들은 휘발성 화학 물질의 처리와 추가 화학 폐기물의 생성을 수반합니다.