주요 차이 - 양성자 대 중성자 대 전자
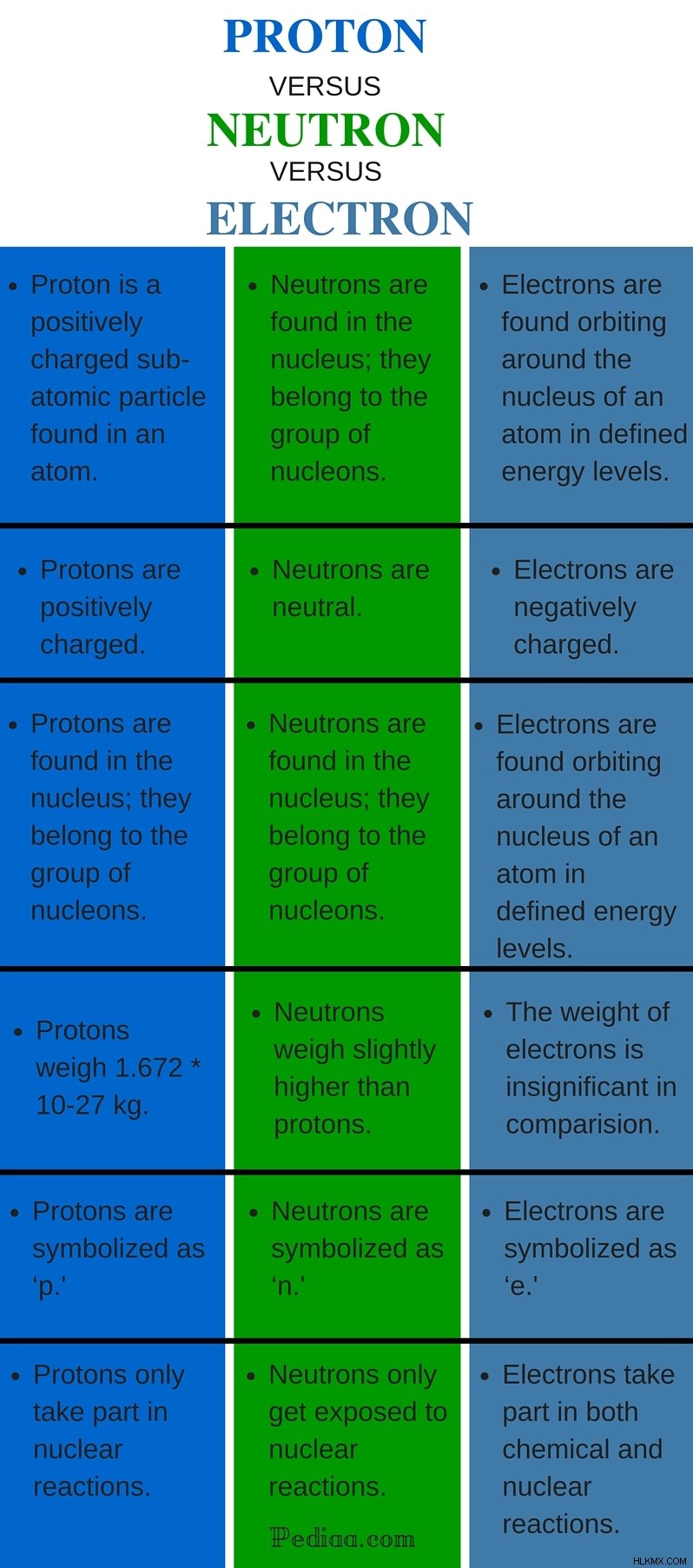
양성자, 중성자 및 전자는 일반적으로 아 원자 입자라고합니다. 그들은 원자를 구성하는 데 필수적인 구성 요소입니다. 각 원자에는 다른 수의 양성자, 중성자 및 전자가 있습니다. 이것이 바로 원자가 자신의 정체성과 독창성을 보존하는 방법입니다. 그들은 다른 요금을 가지고 있으며 대중이 다릅니다. 또한 각 원자 입자의 역할은 서로 상당히 다릅니다. 주요 차이 양성자, 중성자 및 전자 사이에서 전하에서 찾을 수 있습니다. 양성자는 긍정적으로 하전되고 중성자는 중성이며 전자는 음으로 하전됩니다.
양성자
양성자는 원자의 핵에서 발견되며 중성자와 함께 존재합니다. 양성자는 Ardest Rutherford에 의해 발견되었으며, 그는 원자의 대부분이 비어 있다고 주장했으며, 질량은 핵이라고 불리는 원자 내의 작은 조밀 한 영역에만 중심을두고 있다고 주장했다. 양성자는 긍정적으로 하전됩니다 . 이 경우 전하는 전자의 쿨롱 전하의 양으로 정의됩니다. 양성자의 전하는 전자의 전하와 동일하므로 1e로 표현 될 수있다. (1e =1.602 *10 c). 원자 핵은 양성자의 존재로 인해 긍정적으로 하전되어 있습니다.
양성자는 무겁고 1.672 * 10 kg 의 질량이 있습니다. . 위에서 언급 한 바와 같이, 양성자는 원자의 질량에 쉽게 기여한다. 양성자는 중성자와 함께 '핵'이라고 불립니다. 모든 원자에는 하나 이상의 양성자가 존재합니다. 양성자의 수는 각 원자에서 다르고 원자의 동일성을 형성합니다. 주기성 테이블에서 요소가 함께 그룹화되면 양성자 수는 해당 요소의 원자 수로 사용됩니다.
양성자는 ' p 로 상징됩니다 . '양성자는 화학 반응에 참여하지 않으며 원자력 반응에만 노출됩니다. 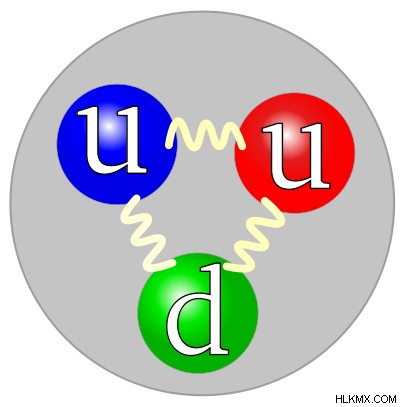
중성자
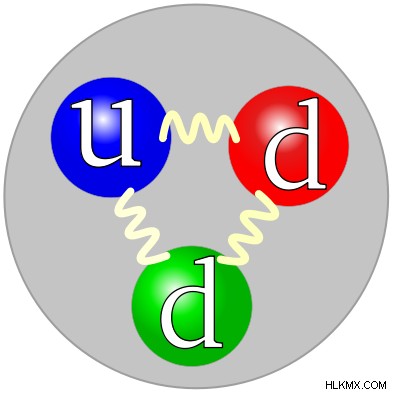
위에서 언급했듯이 중성자는 핵의 양성자와 함께 존재합니다. 그러나 중성자는 하전되지 않음 입니다 입자. 따라서, 그것은 방충 힘없이 양성자와 편안하게 공간을 공유 할 수 있습니다. 예를 들어, 중성자가 부정적인 기소 된 경우 양성자에게 끌 리거나 양이 부과 된 경우 기충이있을 것입니다. 중성자는 양성자보다 약간 높습니다. 그러나 대략 하나의 원자 질량 단위 의 질량으로 간주됩니다. . 중성자 수는 양성자 수와 함께 원자 질량 수를 형성합니다. 핵 내에서 중성자와 양성자의 수는 유사하지 않습니다. 중성자는‘ n 으로 상징 될 수 있습니다 .”중성자는 또한 화학 반응에 참여하지 않으며 원자력 반응에만 노출됩니다.
전자 란 무엇입니까
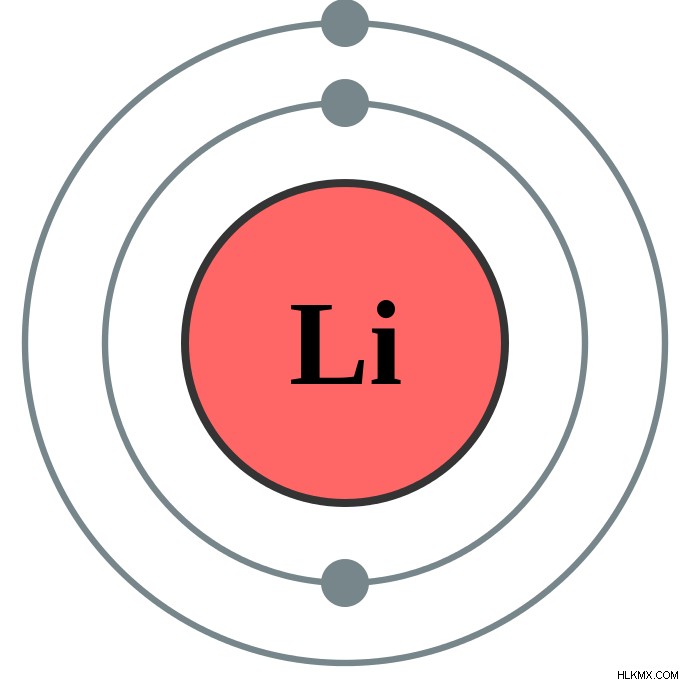
전자는 세 번째 유형의 아 원자 입자이며, 이산 에너지 레벨을 가진 이산 쉘에서 원자의 핵 주위를 궤도로 끄는 것으로 밝혀졌습니다. 전자는 음의 하전 입니다 각 전자는 1e와 동일한 전하를 운반합니다. 전자의 무게가 너무 낮아서 양성자 및 중성자의 중량에 비해 중요하지 않은 것으로 간주됩니다.
양성자 수와 마찬가지로 원자 내의 전자 수는 각 요소의 동일성을 전달합니다. 전자가 각 요소 내의 쉘에 분포되는 방식은 전자 구성으로 표현됩니다. 전자의 수는 원소에서 발견되는 양성자의 수와 유사합니다. 전자는‘ e 으로 상징됩니다 전자는 화학 반응에 참여하는 유일한 아 원자 입자입니다. 그들은 또한 특정 원자력에 참여합니다.
양성자, 중성자 및 전자의 차이
정의
양성자 원자에서 발견되는 긍정적으로 하전 된 아 원자 입자입니다.
중성자 원자에서 발견되는 중성 아 원자 입자입니다.
전자 원자에서 발견되는 음으로 하전 된 하위 원자 입자입니다.
원자 내의 거주지
양성자 핵에서 발견됩니다. 그들은 핵 그룹에 속합니다.
중성자 핵에서 발견됩니다. 그들은 핵 그룹에 속합니다.
전자 정의 된 에너지 수준에서 원자의 핵 주위에 공전하는 것으로 밝혀졌습니다.
충전
양성자 긍정적으로 부과됩니다.
중성자 중립적입니다.
전자 부정적인 부전.
무게
양성자 무게 1.672 * 10 kg.
중성자 양성자보다 약간 높습니다.
전자의 중량 양성자 및 중성자의 무게와 비교할 때 무시할 수 있습니다.
기호
양성자 ‘p.’로 상징됩니다.
중성자 ‘n.’으로 상징됩니다.
전자 ‘e.’로 상징됩니다.
반응
양성자 원자력 반응에만 참여하십시오.
중성자 원자력에만 노출됩니다.
전자 화학 및 원자력에 참여하십시오.