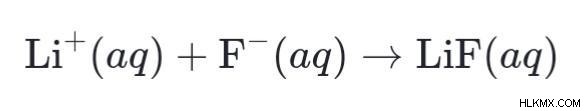1884 년에 Svante Arrhenius라는 스웨덴의 과학자는 이온화 이론에 대해 연구했으며, 그 근거로 산과 염기의 특성을 설명하려고 노력했습니다. Svante가 제안한 이론에서 그는 물과 혼합 될 때 산이 어떻게 반응 할 것인지, 물과 함께 보관할 때베이스가 어떻게 반응 할 것인지 설명했다. 결과적으로, 우리가 물과 산을 함께 혼합 할 때 산은 용액으로 H+ 이온을 방출하여 산에 수소 함량이 있음을 증명하는 것으로 나타났습니다. 다른 한편으로, 우리가 물과베이스를 섞으면 용액에 존재하는베이스는 물과 분리 된 옴을 방출 할 것이다.
전해질이 물에 용해 될 때, 이온화로 간주되는 고려 된 양이온 및 음이온으로서 각각 전기 양성 및 음의 하전 이온으로 분리된다. Arrhenius는 동등한 개념을 기반으로 산과 기초의 구별을 제공하기 위해 노력했습니다.
산과 염기의 차이
산베이스
|
|
|
. |
|
|
|
| 붉은 석회 전환 "> |
|
| Hydroxyl events가 제공됩니다. |
| 0pt "> | pair |
| |
| |
. |
Arrhenius 산
Arrhenius에 따르면 산은 수용액에서 수소 이온의 관심을 확장시키는 모든 종입니다. 우리가 모든 의도와 목적을 위해 염산의 수용액을 만들 때, 용액은 각각의 반응의 생성물로서 수소 및 염소 이온으로 분리되며, 이는 매우 중요합니다. 이러한 결과는 용액에서 수소 이온의 형성을 증가시키기 때문에, 염산은 특히 세련된 방식으로 Arrhenius 산이다.
실제로, 반응이 실험실에 기초하여 일어날 때, 양으로 하전 된 양성자는 일반적으로 주변의 물 분자와 반응하여 대중의 신념과 달리 히드로 늄 이온을 형성하거나 주로 생각했다. 그리고 이것은 반응 당시 실제로 일어나는 일이지만 과학자들은 하이드로 늄 이온을 수소 이온과 동등하게 복용합니다. 따라서 모든 사람에게 가장 흔한 결과가 얻어집니다. 이 응답은 위의 정보가 어떻게 정확하고 실제로 입증 될 수 있는지 보여주는 매우 일반적인 예를 통해 입증 될 수 있습니다.
h+ (aq)+ h2o (l) → h3o+ (aq)
즉각적인 결과로서, 산이 물로 분리 될 때 하이드로 늄 이온의 형성이 보인다. 이것은 과학자들이 화학 반응에 대해 이야기하는 동안 수소 이온과 하이드로 늄 이온이 비슷한 기반을 고려할 때 주로 사용됩니다.
. Arrhenius 기지
Arrhenius베이스는 하이드 록실 이온을 제공하기 위해 물과 분리하는 종입니다. 수용액에서 하이드 록실 이온의 농도를 증가시킨다.
. Arrhenius베이스 예 :그 예는 매우 가용성 수산화 나트륨입니다. 수산화 나트륨은 다음과 같이 물에 해리됩니다 :
naoh (aq) → na + (aq) + oh– (aq)
Arrhenius acid + Arrhenius Base
산과 염기가 과정에서 화학 반응을 견뎌내고 서로 결합을 형성 할 때, 반응은 중화 반응으로 알려져있다. 결과적으로 구입 한 제품은 물과 소금입니다.
물로 산산조물을 분리하는 동안 수소 이온을 생성하고 다른 한편으로는 물로의 염기 분리가 수산화물 이온을 생성 할 때, 이것은 산과 염기의 반응 동안 물과 소금이 어떻게 생성되는지에 대한 주요 전문 지식을 제공합니다.
산 측면으로부터 생성 된 수소 이온과 기본 측정기에서 생성 된 수산화 이온은 함께 물을 얻습니다. 산과 염기의 남은 종은 손을 결합하여 소금을 형성합니다.
예를 들어; 우리는 하이드로 플루오르 산과 수산화 리튬의 수용액을 결합한 다음 다음 반응이 일어날 것입니다.
hf (aq) ⇄ h + (aq) + f– (aq)
결과적으로, 형성된 제품은 최종 제품으로 물과 소금을 형성하기 위해 상승하는 반응을 겪게됩니다. 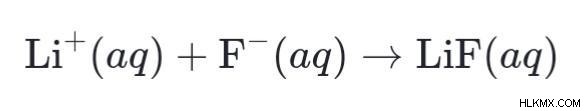
lioh (aq) → li + (aq) + oh– (aq)
산 및 염기의 Arrhenius 이론의 한계 :-
이 이론은 수용액의 산과 염기에만 적용됩니다.
h + (aq) + oh– (aq) → h2o (l)
결론
Svante Arrhenius라는 과학자는 인기있는 "Arhenius Acids and Bases의 이론", 수성 솔루션의 존재에서 각각의 특성과 이온화 이론이 어떻게 관련되어 있는지, 그는 노벨상을 받았습니다. 그러나 이론은 수용액으로 제한되었으며 비-퀴즈 용액의 특성을 충족시킬 수 없었으며, 이는 산과 염기의 Arrhenius 이론의 한계입니다.
.