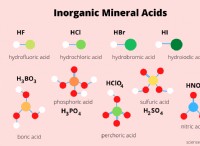
산 또는 염기로 분류되는 물질과 관련하여 고려해야 할 세 가지 주요 범주가 있습니다. Arrhenius 정의에 따르면, 산은 용액에서 H+를 생성하고 염기는 용액에서 OH- 생성을 생성합니다. Svante Arrhenius는 1883 년 에이 이론을 개발했으며 오늘날에도 여전히 사용되고 있습니다. 두 가지 더 정교하고 일반 이론에 대한 이론적 제안은 나중에 이루어졌다. 산과 염기의 Bronsted-Lowry 및 Lewis 정의는 각각 여기에 제시되어 있으며, 산베이스 이론의 계층은이 다이어그램에 묘사되어 있습니다. 루이스 산과 염기의 서브 클래스 인 브론 스테드 산과 염기의 서브 클래스는 Arrhenius 산과 기본 패밀리로 표시됩니다.
산 및 염기를 포함하는 화학 반응은 Arrhenius 이론에 의해 설명되며, 이는 가장 간단하고 가장 일반적인 설명입니다. hclo 4 와 같은 산 및 NaOH 또는 Mg (OH)
그러나 왜 F- 및 No
Arrhenius 이론에서와 같이, 산은 양성자를 방출하는 능력을 가진 물질 인 반면,베이스는 양성자를 수용 할 수있는 물질이다 (Arrhenius 이론과 유사). 예를 들어 Na+F-는 물 자체에서 양성자를 제거하여 물에 수소 이온을 생성하는 기본 염입니다 (HF를 형성하기 위해).
f (aq) +h 2 o (l) ⇌ hf (aq) + Oh
대조적으로, Bronsted 산이 분리 될 때, 그것은 용액에서 수소 이온의 농도를 증가시킨다. [H+]; 대조적으로, 청장진이 분리 될 때, 그것은 용매 (물)로부터 양성자를 가져 와서 [OH]를 초래한다.산성 해리 :ha (aq) aa (aq) + h (aq)
k a =[a] [H]/ha
기본 해리 :b (aq) + h 2 o (l) ⇌ hb (aq) + Oh (aq)
kb =[hb+] [oh-]/[b+]
강하고 약산 및 염기
완전히 분리하는 산 및 염기는 강산 및 염기라고합니다.hclo 4 (aq) H (aq)+clo 4 (AQ)
HBR (aq) aH (aq)+br (aq)
ch 3 o (aq)+h 2 o (l) ⟶치 3 오 (aq)+오 (aq)
NH (aq)+H2O (L) ⟶nh 3 (AQ)+오 (AQ)
오른손 화살표 (ar)는 반응이 결론에 따라 수행 될 것임을 나타냅니다. 결과적으로 HCLO 4 를 희석 할 때 1.0m에서 물에서 실제로 1.0m H (aq)와 1.0 m Clo 4 를 얻습니다. aq), 방해되지 않은 hclo 4 .
대조적으로, 약산 및 아세트산과 같은 염기 (CH 3 COOH) 및 암모니아 (NH <서브> 3 ) 물에 약간만 분리하십시오 - 일반적으로 농도와 k a 의 값에 따라 몇 퍼센트 그리고 KB - 주로 해제되지 않은 분자로 존재한다.
컨쥬 게이트 산 및 염기
컨쥬 게이트 산 및 염기는 양성자 (H+)에 의해 다른 산 및 염기이다.이들 평형의 중요한 결과는 모든 산 (ha)이 컨쥬 게이트 염기 (A-)를 가지고 있으며 그 반대도 마찬가지입니다. 이것은 산-염기 관계라고합니다. 염기 분리 평형에서, 염기 B의 컨쥬 게이트 산은 기호 HB+로 표시된다.
이들 평형 각각은 주어진 산 또는 염기에 대한 수분 해리 평형에 의해 서로 연결된다.
H 2 o (l) ⇌ h (aq) + Oh (aq)
k w =[h+] [oh-]
평형 상수 KW는 25 ° C에서 1.00 x 10 인 경우 온도의 함수입니다. 산 및 염기 해리 상수의 생성물 k a 임을 입증하는 것은 간단합니다. 및 k b 상수 k w 입니다 (물 용).
강산이 약한 컨쥬 게이트 염기를 갖고 약산이 강한 컨쥬 게이트 염기를 갖는다는 생각은 일반적인 오해입니다. k a 를 명심하십시오 k b =k w , 이것이 틀린 것을 보는 것은 간단합니다. 우리는 강한 산 또는 염기를 우리의 정의에 따라 k> 1, 즉 물질이 완전히 분리되는 것으로 정의합니다. 우리는 약한 산 또는 염기를 pH 1> k> k w 로 정의합니다. . 결과적으로 Ka> 1 (strong)이면 KB는 k w 보다 클 수 없습니다. (약한).
HCl과 같은 강산은 컨쥬 게이트 염기로서 작용하는 Cl-와 같은 관중 이온을 생성하기 위해 분리하는 반면, 아세트산과 같은 약산은 약한 컨쥬 게이트 염기를 생성한다. 아세트산 및 그의 컨쥬 게이트 염기의 경우, 아세테이트 음이온. 아세트산은 약산 (ka =1.8 x 10)이고 아세테이트는 약한 염기입니다 (kb =kwka =5.6 x 10). 아세트산은 약산이고 아세테이트는 약한 염기입니다.
가역적 반응에서 물과 반응하여 아세트산의 컨쥬 게이트 염기와 히드로늄을 생성 할 수 있습니다.
컨쥬 게이트 산/염기의 강도는 부모의 산 또는 염기의 강도 또는 약점에 반비례합니다. 기술적이기 위해, 임의의 산 또는 염기는 컨쥬 게이트 산 또는 컨쥬 게이트 염기로 분류 될 수있다; 이 용어는 단순히 용액에서 상이한 종을 구별하는 데 사용된다 (즉, 아세트산은 아세테이트 음이온의 접합체 산, 아세테이트는 아세트산의 컨쥬 게이트 인 산이다).
Linus Pauling이 발견 한 간단한 규칙에 따라, 중성 옥시 난이 (h 2 그래서
하나 이상의 양성자를 기증하는 능력이있는 산을 다발성 산이라고합니다. 황산의 산도를 섭취, H 2 그래서
양서류 특성을 가진 화합물
일부 물질은 산과베이스로 작용하는 능력이 있습니다. 물이 좋은 예입니다. H 2 o 분자는 수소 이온을 기증하거나 수용 할 수있는 능력이있다. 이 때문에 물은 양서류 용매의 특성을 가지고 있습니다. 산이 용액에 분리 될 때, 물은 염기로서 작용하고, 산은 용액에 분리된다. 반면에 물이 분리 될 때 물은 산 역할을합니다. 오 (aq)는 우리가 물에서 만들 수있는 가장 강력한 산이며 H (aq)는 우리가 물에서 만들 수있는 가장 강력한베이스 (aq)입니다.다른 유형의 양서류 화합물 중에는 주기율표에서 금속성과 비금속 요소 사이의 경계의 양쪽에서 발견되는 원소의 산화물 및 수산화물이 있습니다. al (OH)