주요 차이 - 단일 대 이중 대 삼중 채권
화학 결합은 두 원자의 전자와 핵 사이의 힘을 확립함으로써 분자에 원자를 함께 유지합니다. 화학 반응은 화학 결합을 확립하거나 파괴함으로써 통제됩니다. 공유, 이온 성, 반 데르 와알 등과 같은 다양한 유형의 결합이 있습니다. 결합의 특성은 분자의 특성, 고체 유형 (결정질 또는 비정질) 등과 같은 다양한 측면에 따라 다릅니다. 공동 결합은 둘 이상의 전자를 공유하여 형성됩니다. 원자 사이의 공유 전자의 수는 결합의 수를 결정합니다. 단일, 이중 또는 트리플이든. 따라서, 단일, 이중 및 삼중 결합은 공유 결합이다. 단일 이중 및 삼중 결합의 주요 차이점은 공유 전자의 수입니다. 공유 수가 한 쌍의 전자 인 경우, 결합은 단일 결합이되는 반면, 2 개의 원자가 2 쌍 (4 개의 전자)으로 결합되면 이중 결합을 형성합니다. 트리플 본드는 전자의 3 쌍 (6 개의 원자)을 공유하여 형성됩니다. 이 공유 전자는 일반적으로 원자가 전자로 알려져 있습니다. 이 기사는
를 살펴볼 것입니다 1. 단일 채권이란 무엇입니까?
- 정의, 속성, 예
2. 이중 채권이란 무엇입니까?
- 정의, 속성, 예
3. 트리플 본드 란 무엇입니까?
- 정의, 속성, 예
4. 단일 이중 결합과 트리플 본드의 차이점은 무엇입니까? 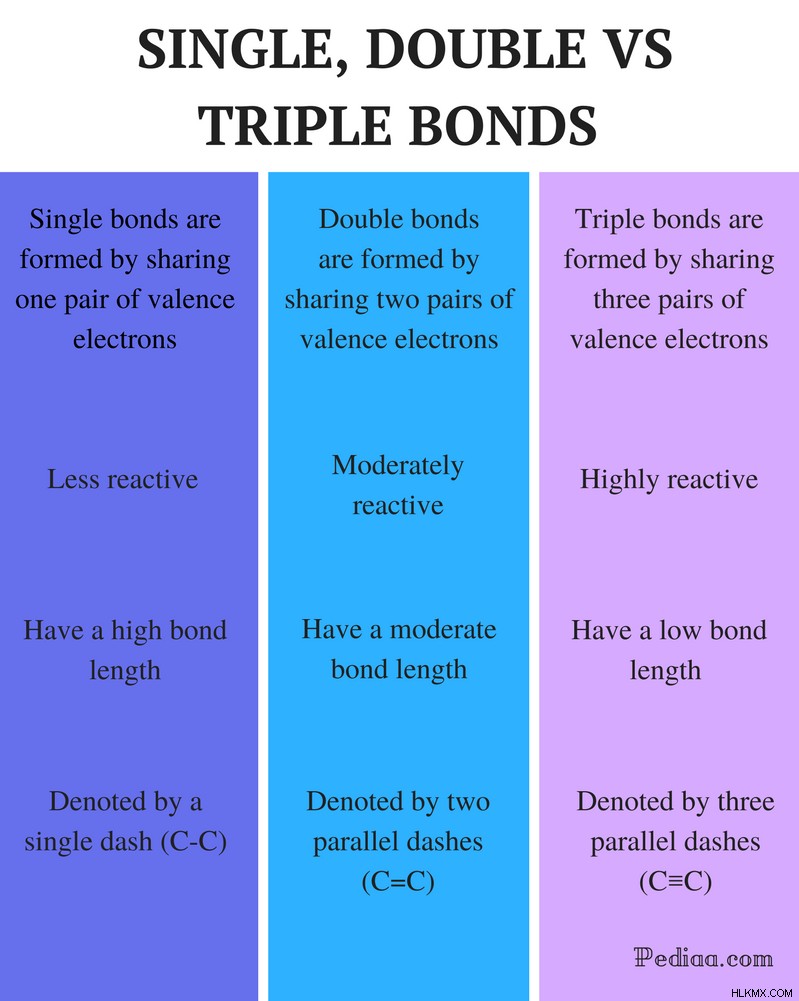
단일 채권은 무엇입니까
단일 결합은 두 개의 인접한 원자 사이에 한 쌍의 원자가 전자를 공유함으로써 형성됩니다. 단일 결합은 가장 간단한 형태의 공유 결합이며, 여기서 각 원자는 하나의 원자가 전자를 제공합니다. 이 원자가 전자는 원자의 가장 바깥 쪽 쉘에 위치하고 있습니다. 여기서, 음으로 하전 된 공유 전자는 긍정적으로 하전 된 원자 핵에 의해 당겨지고있다. 이 당김 힘은 원자를 함께 유지합니다. 이 배열은 단일 채권으로 알려져 있습니다. 단일 결합을 갖는 분자는 다수의 결합을 갖는 분자와 달리 덜 반응성이다. 더욱이, 이들은 다중 결합보다 약하고, 다중 결합과 비교할 때 원자들 사이의 낮은 당기력으로 인해 더 높은 결합 길이를 갖는다. 단일 결합은 단일 대시로 표시됩니다. 예 :C al C. 메탄, 에탄, 프로판과 같은 알칸은 단일 결합을 갖는 화합물의 일부 예입니다.
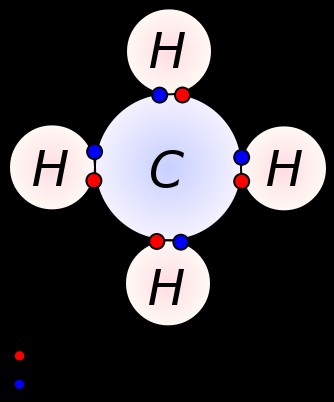
메탄
이중 채권은 무엇입니까
이중 결합은 원자의 가장 바깥 쪽 궤도에 위치한 두 쌍의 원자가 전자를 공유함으로써 형성됩니다. 이중 결합을 갖는 화합물은 단일 결합 화합물보다 반응성이 높지만 삼중 결합을 갖는 화합물보다 덜 반응성이다. 이중 결합은 2 개의 평행 대시로 표시됩니다. 예 :c =c. 이중 결합을 갖는 화합물의 일부 예에는 에틸렌, 프로 펜, 카르 보닐 화합물 (C =O), 아조 화합물 (n =N), 이민 (C =N) 및 설록 사이드 (S =O)와 같은 알켄이 포함됩니다.
.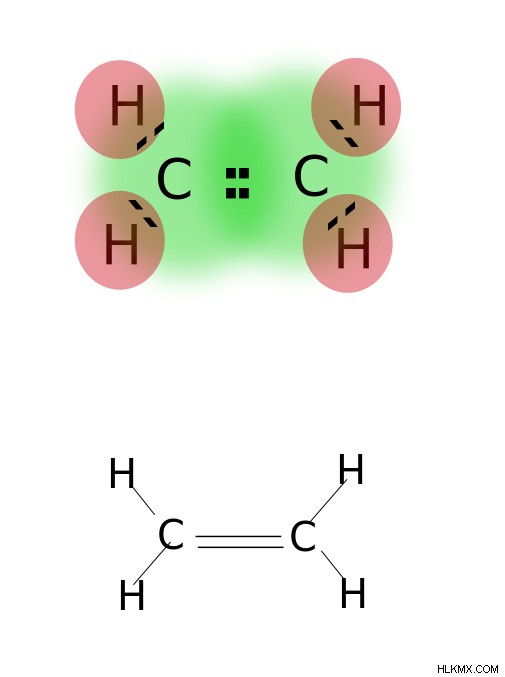
에틸렌
트리플 본드
2 개의 원자가 3 쌍의 원자가 전자 (6 개의 원자가 전자)를 공유하면 확립 된 결합을 트리플 본드라고합니다. 삼중 결합은 가장 강력하고 가장 반응성이 높은 공유 결합입니다. 단일 및 이중 결합과 비교할 때, 트리플 결합은 두 원자 사이의 높은 당구력으로 인해 가장 낮은 결합 길이를 갖는다. 트리플 결합은 2 개의 원자 사이에 3 개의 평행 대시로 표시됩니다. 예 :C≡C. 삼중 결합을 갖는 화합물의 일부 예로는 질소 가스 (N≡N), 시안화물 이온 (C≡N), 아세틸렌 (CH≡CH) 및 일산화탄소 (C≡O)가 포함됩니다.
.
아세틸렌
단일 이중 및 트리플 본드의 차이
정의 :
단일 채권 : 한 쌍의 원자가 전자를 공유하여 단일 결합이 형성됩니다.
이중 채권 : 두 쌍의 원자가 전자를 공유함으로써 이중 결합이 형성된다.
트리플 본드 : 3 쌍의 원자가 전자를 공유하여 트리플 본드가 형성됩니다.
반응성 :
단일 채권 : 단일 결합은 덜 반응성입니다.
이중 채권 : 이중 결합은 적당히 반응성입니다.
트리플 본드 : 삼중 결합은 반응성이 높습니다.
결합 길이 :
단일 채권 : 단일 채권은 결합 길이가 높습니다.
이중 채권 : 이중 결합은 적당한 결합 길이를 갖는다.
트리플 본드 : 트리플 본드는 결합 강도가 낮습니다.
로 표시 :
단일 채권 : 단일 본드는 단일 대시 (C-C)로 표시됩니다.
이중 채권 : 이중 결합은 2 개의 평행 대시 (C =C)로 표시됩니다.
트리플 본드 : 트리플 본드는 3 개의 평행 대시 (C≡C)로 표시됩니다.
예 :
단일 채권 : 예로는 메탄, 에탄, 프로판, 부탄 등과 같은 알칸이 포함됩니다.
이중 채권 : 예는 에틸렌, 프로 펜, 카르 보닐 화합물 (C =O), 아조 화합물 (N =N), 이민 (C =N) 및 설폭 사이드 (S =O)를 포함한다.
트리플 본드 : 예로는 질소 가스 (N≡N), 시안화물 이온 (C≡N), 아세틸렌 (CH≡CH) 및 일산화탄소 (C≡O)가 있습니다.
.참고 문헌 :
클로우, 마틴. 유기 화학의 기초 . N.P. :The Rosen Publishing Group, 2013. Print.Cracolice, Mark S. 수학 검토와 함께 소개 화학의 기본 사항 . 출판지 식별 장소 :Brooks Cole, 2006. Print.manahan, Stanley E. 환경 화학의 기초 . 제 3 판. N.P. :CRC Press, 2011. Print.Gray, Harry B., John D. Simon 및 William C. Trogler. 요소를 용감하게합니다 . SAUSALITO, CA :U Science, 1995. 인쇄. 이미지 제공 : Dynablast의 “공유”-Commons Wikimedia를 통해 잉크 스케이프 (CC By-SA 2.5)로 생성되었습니다. “Azetylenelektr”자신의 작업에 의한 - ф. ...의 деркак“хімія”л. Commons Wikimedia를 통해 1968 (공개 도메인) Commons Wikimedia를 통해 NL.Wikibooks (CC By-SA 2.5)에서 JCWF의 “Ethen”