주요 차이 - 감소 제와 산화제
환원제 및 산화제는 산화 환원 반응과 관련된 화학 화합물입니다. 이들 화합물은 산화 환원 반응의 반응물이다. 환원제와 산화제의 주요 차이점은 는 환원제가 전자를 잃고 산화 될 수 있지만 산화제는 전자를 얻고 감소 될 수 있다는 것입니다.
주요 영역을 다루었습니다
1. 환원제
- 정의, 특성, 반응 메커니즘, 예
2. 산화제
- 정의, 특성, 반응 메커니즘, 예
3. 감소 제와 산화제의 차이점은 무엇입니까
- 주요 차이 비교
주요 용어 :반 반응, 산화, 산화 상태, 산화제, 산화 환원 반응, 감소 제, 감소 
환원제
환원제는 전자의 일부를 잃어서 산화 될 수있는 물질입니다. 전자의 손실은 원자의 전하가 전자의 음전하에 의한 핵의 양전하의 균형에 의존하기 때문에 환원제가 양전하를 얻는다. 따라서, 전자를 잃은 후에, 핵의 상응하는 양전하의 균형을 맞추기에 충분한 음전하가 없다. 따라서 양전하가 남아 있습니다. 이 전하는 원자의 산화 상태라고합니다.
환원제는 동일한 요소 또는 다른 요소를 포함하는 물질 일 수 있습니다. 환원제가되기 위해, 여러 원소로 구성된 화합물은 가능한 산화 상태에있는 최소 하나 이상의 원소를 가져서이 원소가 더 높은 산화 상태로 산화되어 전자를 잃어 버릴 수 있어야한다. 예를 들어, So
산화 환원 반응에서 전체 반응은 해당 시스템에서 발생하는 절반 반응으로부터 얻어진다. 두 절반 반응은 산화 반응 및 환원 반응입니다. 산화 반응은 항상 환원제의 산화를 나타냅니다.
유기 화학에서, 적색 또는 감소 알루미늄 화합물은 일반적으로 사용되는 환원제입니다. 다음 이미지는이 화합물에 의해 감소 된 기능 그룹을 보여줍니다.
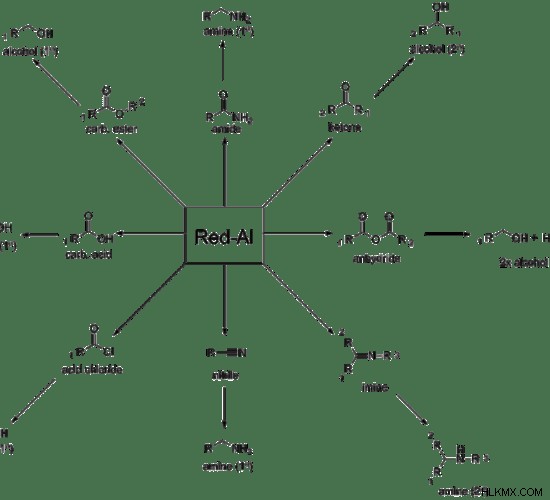
그림 1 :red-al. 의 반응
환원제의 산화 반응
후속 조치는 반응의 유형이 감소하는 대리인이 겪는 유형입니다.
산화 상태가 양성 산화 상태로의 산화
lithium (li)은 +1 산화 상태를 얻는 전자를 쉽게 잃어 버리기 때문에 강력한 환원제입니다. 반 반응은
입니다li → li +e
양성 산화 상태의 더 높은 양성 산화 상태로의 산화
. h 2 c 2 o 4 또한 좋은 환원제입니다. C 원자의 산화 상태는 +3이다. C 원자가 가질 수있는 가장 높은 산화 상태는 +4입니다. 따라서, Co
h 2 c 2 o 4 → 2co 2 +2H +2E
음성 산화 상태를 제로 산화 상태로 산화
o 2 산화물에서 O로부터 생성 될 수있다. 예를 들어, ag 2 O는 Ag 및 O 2 로 산화 될 수 있습니다 .
2Ag 2 O → 4AG +O 2
음성 산화 상태의 양성 산화 상태로의 산화
h 2 의 산화 s로 h 2 그래서
s +4h 2 o → So 4 +8H +8E
산화제
산화제는 전자를 얻어 줄 수있는 물질입니다. 따라서 산화 환원 반응에서 전자 수신기 또는 수용체라고합니다. 환원의 절반 반응은 산화제가 겪는 반응이다. 전자가 외부에서 얻어지면 핵에 의해 완전히 중화 될 수없는 더 많은 음전하가 있습니다. 따라서, 원자는 음전하를 얻습니다. 그러나이 감소가 양으로 하전 된 원자에서 발생하면 더 낮은 양전하 또는 중립 전하를 얻을 수 있습니다.
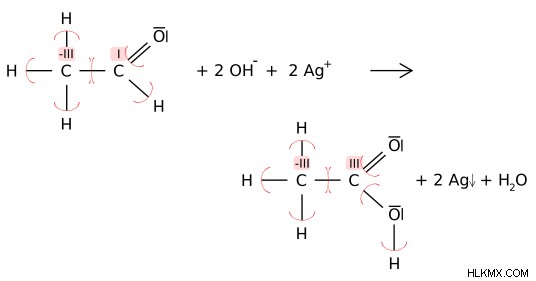
그림 2 :환원제 C2H4O는 Ag+를 Ag로 감소시킨다. 그곳에서, 알데히드 탄소 (I)의 산화 수는 카르복실산 탄소 원자에서 (iii)로 산화된다.
산화제에서 감소는 원자의 산화 상태가 감소되게 만듭니다. 예를 들어, 양전하가있는 원자 (예 :NA)가있는 경우 산화 상태 (Nainto NA)로 감소 될 수 있습니다. 유사하게, 전하가 0 인 원자 또는 분자 (예 :o 2 )는 음전하로 축소 될 수 있습니다 (O 2 2o로).
산화제의 환원 반응
산화제 감소는 주로 다음과 같은 방식으로 발생할 수 있습니다.
산화 상태가 음의 산화 상태로의 감소
산소 (o 2 ) 및 오존 (O 3 ) 산화제 역할을 할 수 있습니다. 그들은 O로 감소합니다.이 감소 된 형태는 h 2 의 o와 같은 다른 형태로 포함될 수 있습니다. O 및 Co 2 .
o 2 +4H +4E → 2H 2 o
양성 산화를 낮은 양성 산화 상태로의 감소
mno 4 의 망간 (mn) mn 또는 mno 2 로 축소 될 수 있습니다 (Mn).
mno 4 +8H +5E → Mn +4H 2 o
양성 산화 상태를 제로 산화 상태로의 감소
hf (-1 산화 상태 f)는 f 2 로 축소 될 수 있습니다. (F의 산화 상태 제로).
2 hf → f 2 +h 2
2f → f 2 +2e
양성 산화 상태를 음성 산화 상태로의 감소
so 4 (+6 산화 상태)는 h 2 로 감소 될 수 있습니다 S (-2 산화 상태).
so 4 +8H +8E → S +4H 2 o
감소 제와 산화제의 차이
정의
감소 에이전트 : 환원제는 전자의 일부를 잃어서 산화 될 수있는 물질입니다.
산화제 : 산화제는 전자를 얻어 줄 수있는 물질입니다.
산화 상태
감소 에이전트 : 환원제의 산화 상태가 증가한다.
산화제 : 산화제의 산화 상태는 감소한다.
전자 교환
감소 에이전트 : 감소 제는 전자 공여자 역할을한다.
산화제 : 산화제는 전자 수신기 역할을한다.
제제에서 산화 상태의 변화
감소 에이전트 : 환원제는 반응 동안 산화된다.
산화제 : 반응 동안 산화제가 감소된다.
다른 반응물에서 산화 상태의 변화
감소 에이전트 : 감소 제는 다른 반응물의 감소를 유발합니다.
산화제 : 산화제는 다른 반응물의 산화를 유발합니다.
결론
환원제 및 산화제는 산화 환원 반응과 관련된 화학 화합물입니다. 환원제와 산화제의 주요 차이점은 환원제가 전자를 잃고 산화 될 수 있지만 산화제는 전자를 얻고 감소 될 수 있다는 것입니다.