핵심 개념
이 화학 자습서에서는 버퍼 에 소개됩니다. 버퍼의 정의와 산성 및 기본 완충액 솔루션의 구성 요소를 학습함으로써 그리고 그들이 첨가 된 산과 염기와 어떻게 반응하는지. 또한 다른 잠재적 버퍼의 예를 배우게됩니다. 마지막으로, 우리는 헨더슨 Hasselbalch 방정식을 다룰 것입니다. 버퍼 솔루션이란 무엇입니까?
다른 기사에서 다루는 주제
- 산 기본 화학
- 산 및 염기의 특성
- 루이스 산 및베이스의 정의
- 강산 및 염기
- 산 기본 이론
- 일반적인 이온 효과
버퍼 솔루션 정의
화학에서, 버퍼의 정의 산 또는 염기를 첨가 할 때 pH 변화에 저항 할 수있는 솔루션입니다. 그것은 약산과 그의 컨쥬 게이트베이스의 용액으로 구성되거나 그 반대도 마찬가지입니다.
완충액은 산 염기 화학에 사용되는 매우 유용한 솔루션입니다. 때로는 용액이 강산 또는 염기와 혼합되면 pH는 빠르고 극적으로 변화 할 수 있습니다. 완충액은 첨가 된 산 또는 염기의 일부를 중화시켜 pH가 점차적으로 변화 할 수 있도록 도와줍니다. 이것은 수소 또는 수산화물 이온과 반응하여 최대 용량으로 pH에 영향을 줄 수 없도록 구성 요소로 구성되어 달성됩니다.
버퍼 솔루션은 중화 할 수있는 금액에 대한 제한이 있습니다. 이 버퍼가 용량에 도달하면 솔루션은 버퍼가없는 것처럼 작용하고 pH는 다시 한 번 극적으로 변화를 시작할 수 있습니다.
완충제를 사용하여 강산 및 염기를 분석하고 실험하는 것이 더 쉬워집니다. 혈액의 pH를 조절하는 데 사용되는 바이오 카보네이트 완충 시스템은 완충제의 실제 세계 사용의 예입니다.
버퍼 솔루션의 구성 요소
완충액은 두 가지 선택 중 하나 인 약산과 그의 컨쥬 게이트 염기 또는 약한 염기 및 그의 컨쥬 게이트 산을 포함해야합니다. 구성 요소를 선택하는 방식은 용액의 원하는 pH와 관련이 있습니다.
산성 완충액

산성 완충액은 pH가 7 미만이고; 이 용액은 약산과 그의 접합체베이스로 염으로 만들어집니다. 용액의 pH를 변경하려면 산과 염의 비율을 변경할 수 있습니다. 또한, 다른 산 (컨쥬 게이트 염과 함께)은 다른 방식으로 pH에 영향을 줄 수 있습니다.
아세트산 및 나트륨 아세테이트는 약산 및 그의 컨쥬 게이트 염의 예입니다. 산 평형이 남아 있습니다. 그러나 아세테이트 나트륨을 첨가하면 아세테이트 이온이 용액에 첨가됩니다. Le Chatelier의 원칙으로 인해 평형은 왼쪽으로 전환됩니다.
ch 3 cooh (aq) CH3COO (aq) + h (aq)
산성 완충제에 산 첨가
예제 버퍼를 위에서 염두에두면 산을 첨가하면 어떻게됩니까? 완충액은 들어오는 산에서 수소 이온을 제거하기 위해 작동해야합니다. 아세테이트 이온은 이들 수소 이온과 결합하여 아세트산을 생성 할 것이다. 아세트산은 약산이기 때문에, 반응은 아세트산이 다시 해리 될 수있는 것보다 더 빨리 수소 이온을 제거 할 수있다; 이것이 pH가 극적으로 변하지 않는 이유입니다.
산성 완충제에베이스를 추가
다시 말하지만, 위의 버퍼 솔루션을 명심해 봅시다. 이 버퍼와 상호 작용하기 위해베이스를 추가하는 것이 조금 더 복잡합니다. 아세트산은 염기로부터의 수산화물 이온과 상호 작용하여 아세테이트 이온이 물과 함께 형성되게한다; 수산화물 이온이 이로부터 제거되기 때문에 pH의 증가를 유발하지 않을 것이다. 또한, 아세트산의 해리로부터의 여분의 수소 이온은 또한 수산화물과 결합하여 물을 형성 할 수있다. 이러한 방법으로, 대부분의 수산화물 이온은 수소 이온과 상호 작용하여 기본 존재를 제거하지만 pH를 크게 변화시키기에는 충분하지 않습니다.
기본 (알칼리성) 완충액

기본 완충액은 7보다 큰 pH를 갖고; 이 용액은 약한 염기와 그의 접합체 산으로 만들어졌다. 두 성분의 농도는 시작과 같아야합니다. 그러나 산성 완충제와 마찬가지로 염기와 산성 염의 비율을 변경하여 용액의 pH를 변경할 수 있습니다.
암모니아 및 염화 암모늄은 그의 컨쥬 게이트 산을 가진 약한 염기의 예입니다. 평형은 왼쪽으로 가고있다. 그러나 염화 암모늄을 첨가하면 암모늄 이온이 용액에 첨가됩니다. 이번에는 Le Chatelier의 원칙이 평형이 더 왼쪽으로 이동하게됩니다.
nh 3 (aq) + h 2 o ( l ) nh 4 (aq) + Oh (aq)
기본 완충제에 산을 첨가
위의 예제 버퍼를 염두에두고 산을 첨가하면 어떤 일이 발생하는지 분석하겠습니다. 첨가 된 산으로부터의 수소는 암모니아와 상호 작용하여 암모늄 이온을 형성 할 것이다. 이로 인해 많은 수소 이온이 제거됩니다. 또한, 암모니아와 물 사이의 반응으로 인해 용액에는 일부 수산화 이온이있다; 이들 수산화물 이온은 산성 수소와 상호 작용하여 더 많은 물을 형성 할 것이다. 이러한 방법은 대부분의 수소 이온이 산성 존재를 제거하여 pH 변화를 완충시키는 데 도움이됩니다.
.기본 버퍼에베이스 추가
베이스가 위에서 버퍼 솔루션에 추가 된 경우 어떻게해야합니까? 완충액은 들어오는베이스에서 수산화 이온을 제거하기 위해 작동해야합니다. 용액의 암모늄 이온은 수산화 이온과 반응합니다. 암모니아는 약한 염기이기 때문에 물과 반응 할 때 반응이 역전 될 수 있지만 모든 수산화 이온이 용액에서 제거되는 것은 아닙니다. 이로 인해 pH는 극적으로 변하지 않습니다.
버퍼 솔루션 예제
- 아세트산 및 컨쥬 게이트 염기 :ch 3 COOH &ch 3 COO
- 포름 산 및 접합체베이스 :hcho 2 &Cho
2 - 피리딘 &컨쥬 게이트 산 :c 5 h 5 n &c 5 h 5 h
- 암모니아 및 컨쥬 게이트 산 :nh 3 &nh 4
- 메틸 아민 및 접합체 산 :ch 3 nh 2 &ch 3 nh 3
Henderson Hasselbalch 방정식
약산과 그의 컨쥬 게이트 염기를 사용하여 완충액을 생성하면 완충액을 유지하고 소량의 추가 산 또는 염기가 첨가되면 해당 pH의 변화에 저항 할 수 있습니다. Henderson Hasselbalch 방정식 아래에 표시된 것은 약산의 PKA를 사용하여 완충 pH의 것을 계산합니다. 별도의 기사 에서이 방정식을 사용하여 자세한 예를 들어 보겠습니다.
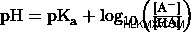
추가 읽기
- 화학 반응이 쉬워졌습니다
- 혼합물 대 화합물
- le Chatelier의 원칙
- 산화 환원 반응 이해







