pH는 수질을 결정할 때 측정되는 주요 매개 변수입니다. 그것은 수원이 음주 목적으로 사용하기에 좋은 품질인지 및 기타 주택 보유 요구 여부를 나타냅니다. 또한, 적절한 pH를 유지하는 것은 일부 화학 반응에도 중요합니다. 시스템의 pH는 해당 시스템에 존재하는 수소 이온의 농도에 의존한다. 용액에서 수소 이온의 농도는 1 리터의 용액에 존재하는 수소 이온 (mol의 단위)의 양이다. pH는 수소 이온 농도의 역수의 로그 값이다. 이것은 수소 이온과 ph.
의 관계입니다주요 영역을 다루었습니다
1. 수소 이온은 무엇입니까
- 정의, 속성
2. pH
- 정의, 속성, 스케일 및 측정
3. 수소 이온과 pH의 관계는 무엇입니까
- 예제에 대한 설명
주요 용어 :산도, 알칼리도, 염기성, 수소 이온, 하이드로 늄 이온, pH, 양성자

수소 이온은 무엇입니까
수소 이온은 요소 수소의 이온 형태입니다. 이것은 기호 H에 의해 주어진다. 이온은 전자가 제거되거나 원자에 첨가 될 때 형성된다. 전자가 원자에서 제거되면 양이온이됩니다. 전자가 원자에 첨가되면 음이온이됩니다. 수소는 기체상에서 중성 원자에 전자가 하나뿐입니다. 수소의 가장 안정적인 동위 원소는 핵에 양성자를 함유한다. 따라서, 핵의 양전하 (양성자의 존재로 인해)는 유일한 전자에 의해 중화된다. 그러나이 전자가 수소 원자에서 제거 될 때, 양으로 하전 된 양성자 만 존재한다. 따라서 수소는 수소 이온이됩니다.이, 수소 이온은 단지 양성자입니다.
수용액 에서이 수소 이온 또는 양성자는 h 2 와 함께 사용됩니다. o (물) 분자. 그런 다음 hydronium 이온 이라고합니다 . 히드로 늄 이온의 상징은 H 3 입니다 O.이 기호는 h-h 2 에서 생성됩니다 o 조합.

그림 1 :하이드로 늄 이온의 화학 구조
화합물의 산도는 수소 이온 (또는 양성자)을 방출하는 능력에 의해 결정됩니다. 따라서, 강산은 그들이 가지고있는 모든 수소 이온을 완전히 이온화하고 방출 할 수있는 화합물이다. 약산은 이온에 부분적으로 분리되어 일부 수소 이온을 방출 할 수있는 화합물이다. 시스템에 존재하는 수소 이온의 양은 해당 시스템의 pH를 보면 결정할 수 있습니다. 산-염기 적정은 주로 시스템에 존재하는 수소 이온에 기초한다. 염기는 산의 수용액에 존재하는 수소 이온의 수를 결정하는 데 사용될 수 있습니다.
또한 수소 이온도 음이온이 존재할 수 있습니다. 수소 원자는 1s 궤도에서 짝을 이루지 않은 전자를 갖기 때문에 궤도를 완성하고 헬륨 (HE)의 전자 구성을 얻기 위해 다른 전자를 S 궤도로 가져올 수 있습니다. 그런 다음 H로 표시됩니다. 이것은 수소 원자가 양성자로 구성되어 있고 들어오는 전자를 중화하기 위해 원자에 다른 양전하가 없기 때문에 발생합니다.
.일반적으로 수소는 대부분의 다른 요소에 비해 전기 음성이 덜하기 때문에 양의 이온을 형성하는 경향이 있습니다. 그러나 수소보다 전기 음성이 매우 낮은 금속과 같은 요소에 결합되면 양이온 대신 음이온을 형성하는 경향이 있습니다.
란 무엇입니까?
pH는 수소 이온 농도의 역수의 로그 값입니다 (보다 정확하게 수소 이온의 활성). pH는 실제로 시스템의 산도 또는 염기성 (알칼리성)을 결정하는 데 사용되는 척도입니다. 로그 값은 용액의 수소 이온 농도가 양이 매우 적기 때문입니다. 예를 들어, 25C에서 순수한 물의 수소 이온 농도는 약 10 mol/L이다. 따라서, 수소 이온의 농도는 활성 대신 고려되며, 이들 농도를 쉽게 식별하고 비교할 수 있도록 로그 값이 사용된다. pH를 계산할 때, 수소 이온 농도의 단위는 mol/l로 가져 가야합니다.
pH 척도는 1에서 14까지 다양합니다. pH 7은 시스템의 중립적 pH로 간주됩니다. 산은 7 미만의 pH 값을 가지고 염기는 pH 7 이상의 pH 값을 갖는다. 강산은 1 내지 3 사이의 pH 값을 나타내며, 약한 산은 4에서 6까지의 pH 값을 나타낸다. 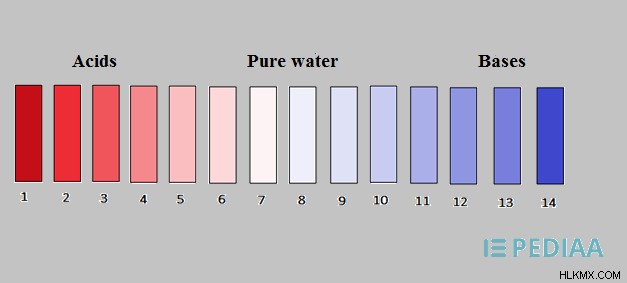
그림 2 :pH 스케일
pH는 다양한 방법을 사용하여 측정 할 수 있습니다. 리트머스 용지를 사용하여 솔루션이 산성인지 염기성인지 결정할 수 있습니다. pH 종이를 사용하여 pH 값을 정수로 결정할 수 있습니다. 적정 방법을 사용할 수 있습니다.
수소 이온과 pH 사이의 관계
수소 이온과 pH 사이에는 직접적인 관계가 있습니다. 용액의 pH는 해당 용액의 수소 이온 농도에 의존한다. pH 값은 수소 이온 활성의 역수의 로그 값이다. 수소 이온의 농도는 종종 매우 낮기 때문에, 이온 활성은 수소 이온의 농도와 동일하게 간주된다. 그런 다음 pH는 수소 이온 농도의 역수의 로그입니다.
ph =-log 10 [a h+ ]
여기서 A는 활동입니다.
ph =-log 10 [h (aq) ]
따라서 용액에서 pH와 수소 이온의 농도 사이에는 직접적인 관계가 있습니다.
결론
용액의 pH는 주로 해당 용액의 수소 이온 농도에 의존합니다. 수소 이온 농도는 해당 용액에 존재하는 화학 종과 해당 용액의 온도의 변화에 따라 달라집니다.