주요 차이 - 전기 화학적 세포 대 전해 세포
전기 화학에는 화학 공정이 발생하는 시스템에서 전자의 움직임에 대한 연구가 포함됩니다. 여기서, 화학 반응은 전류를 생성하는데 사용될 수 있거나, 전류를 사용하여 비 완전 화학 반응이 발생하도록 촉진 할 수있다. 두 가지면에서, 전기 에너지를 화학 에너지로 전환하거나 그 반대가 발생할 것이다. 이러한 전환이 발생하는 시스템은 세포 또는보다 정확하게 전기 화학적 세포로 알려져 있습니다. 볼타 세포와 전해 세포로 알려진 두 가지 유형의 전기 화학 세포가 있습니다. 전기 화학 세포와 전해 세포의 주요 차이점은 전기 화학 셀이 작동을 위해 외부 전류가 필요하지 않다는 것입니다 전해 세포는 작동하려면 외부 전류가 필요합니다.
주요 영역을 다루었습니다
1. 전기 화학적 세포
- 정의, 속성, 작동 방식
2. 전해 세포
- 정의, 속성, 작동 방식
3. 전기 화학 세포와 전해 세포의 차이점은 무엇입니까?
- 주요 차이점 비교
주요 용어 :양극, 음극, 전기 화학 세포, 전기 분해, 전해 세포, 갈바니 세포, 산화, 환원, 볼타 세포 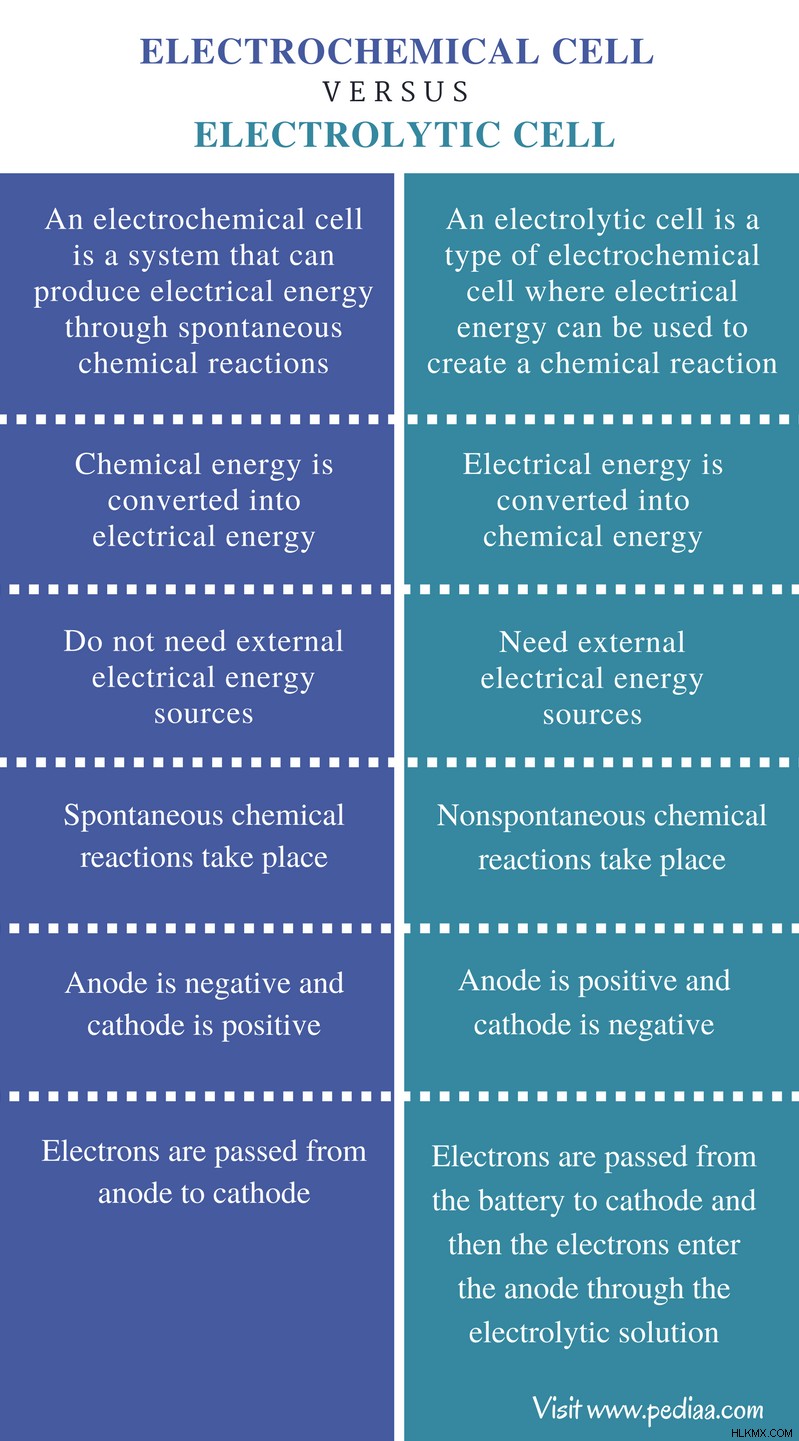
전기 화학적 세포
전기 화학 셀은 자발적인 화학 반응을 통해 전기 에너지를 생성 할 수있는 시스템입니다. 이 과정에 관여하는 화학 반응을 산화 환원 반응이라고합니다. 산화 환원 반응은 화학 종 사이의 전자를 전달함으로써 발생합니다. 산화 환원 반응에는 산화 반응 및 환원 반응의 두 가지 반 반응이 포함됩니다. 산화 반응은 항상 전자를 시스템으로 방출하는 반면 환원 반응은 시스템에서 전자를 취합니다. 따라서 두 개의 반 반응이 동시에 발생합니다.
전기 화학 세포는 볼타 (갈바닉) 세포와 전해 세포와 같이 두 가지 유형으로 발견됩니다. 전기 화학적 세포는 2 개의 절반 세포로 구성됩니다. 반 반응은 2 개의 절반 세포에서 발생합니다. 그 세포에서 발생하는 화학 반응은 두 절반 세포 사이의 전위차를 유발합니다.
반 셀은 전극과 전해질로 구성되어야합니다. 따라서, 완전한 전기 화학적 세포는 2 개의 전극 및 2 개의 전해질로 구성된다; 때때로, 두 절반 세포는 동일한 전해질을 사용할 수 있습니다. 사용 된 두 가지 전해질이 사용되면 전해질 사이의 접촉을 유지하기 위해 소금 브리지를 사용해야합니다. 그것은 소금 다리를 통해 이온을 전달하는 통로를 만들어 이루어집니다. 전자는 외부 회로를 통해 1/2 셀에서 다른 절반으로 흐릅니다. 두 전극을 양극과 음극이라고합니다.
산화 및 환원 반응은 두 개의 전극에서 개별적으로 발생합니다. 산화 반응은 양극에서 발생하는 반면, 환원 반응은 캐소드에서 발생합니다. 따라서, 전자는 양극에서 생성되며, 이들은 외부 회로를 통해 양극에서 캐소드로 이동한다. Salt Bridge는 전하의 균형을 맞추기 위해 이온을 전달하여 시스템 중립 (전기)을 유지하는 데 도움이됩니다.
다음 전기 화학적 세포를 고려해 봅시다.
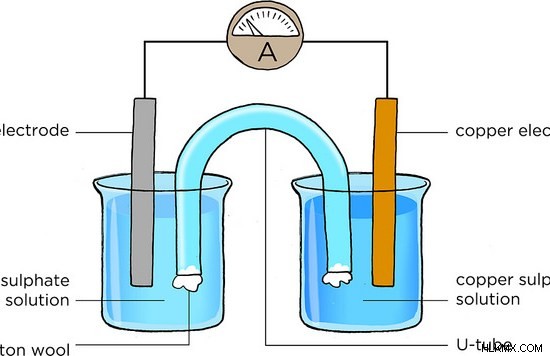
그림 1 :전기 화학 세포
여기서, 여기서, 양극은 Zn (아연) 전극이고 음극은 Cu (구리) 전극입니다. 산화 반응은 Zn 전극에서 발생합니다. 그곳에서, 금속성 Zn은 Zn 이온으로 산화된다. 방출 된 전자는 외부 와이어를 통과합니다. 생산 된 Zn 이온은 용액으로 방출됩니다. 따라서 Zn 전극은 시간이 지남에 따라 용해됩니다. 환원 반응은 음극 근처에서 발생합니다. 캐소드는 CU 전극입니다. 그곳에서, 외부 회로에서 나오는 전자는 용액의 cu 이온에 의해 채취되고 Cu 금속으로 감소된다. 따라서, Cu 전극의 질량은 시간이 지남에 따라 증가 될 것이다. 외부 와이어를 통한 전자 흐름은 산화 환원 반응으로부터 생성 된 전류로 측정 될 수있다. 이것은 전기 화학 세포의 전형적인 구조입니다.
반응
- 양극의 반응 (산화)
zn (s) → zn (aq) +2e
- 캐소드에서의 반응 (환원)
cu (aq) +2e → Cu (s)
전해 세포
전해 세포는 전기 에너지를 사용하여 화학 반응을 일으키는 전기 화학적 셀의 한 유형입니다. 다시 말해, 전기 에너지는 외부 소스에서 공급되어야합니다. 그런 다음 비전문 반응을 시작할 수 있습니다. 전해 세포는 화합물의 전기 분해에 가장 일반적으로 사용됩니다.
전해 세포는 또한 고체 금속으로 전극으로 구성됩니다. 외부 회로에 연결된 두 개의 전극이 있습니다. 하나의 전극은 양극으로 작용하는 반면 다른 하나는 음극 역할을합니다. 산화 반응은 양극에서 발생하고 환원 반응은 캐소드에서 발생합니다.
.외부 전기 에너지 공급 (두 개의 전극에 연결된 배터리에서)은 음극을 통한 전자 흐름을 제공합니다. 이 전자는 전해 용액으로 들어갑니다. 그런 다음 용액의 양이온은 음극 주위에 모여 음극을 통해 오는 전자를 얻습니다. 따라서,이 양이온은 음극에서 감소된다. 캐소드의 전자는 용액에서 음이온을 격퇴한다. 이 음이온은 양극으로 이동합니다. 그곳에서,이 음이온은 전자를 방출하고 산화된다. 따라서 양극은 양전하가 있고 음극은 음전하를 갖습니다.
다음 예를 고려해 봅시다.
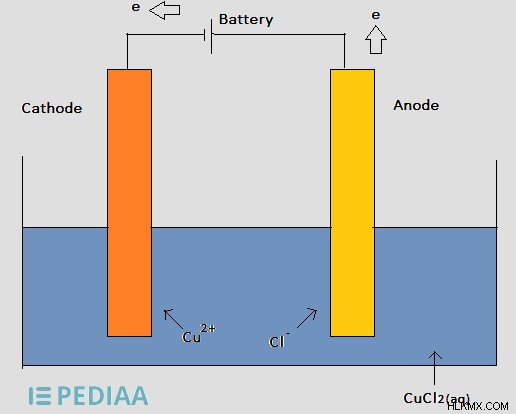
그림 2 :염화 구리 용액의 전기 분해
위의 전해 셀에서 배터리는 음극에 전자를 제공하고 cu 이온은 음극 주위에 모여 음극에서 전자를 가져갑니다. 이어서, Cu 이온은 Cu 금속으로 감소되고 캐소드에 증착된다. 그런 다음 CL 이온은 양극으로 이동하여 과잉 전자를 방출합니다. 거기서, Cl의 산화는 Cl 2 (g) 를 형성하는 것으로 나타난다 .
반응
- 양극의 반응 (산화)
2cl (aq) → Cl 2 (g) +2e
- 캐소드에서의 반응 (환원)
cu (aq) +2e → Cu (s)
전기 화학적 세포와 전해 세포의 차이
정의
전기 화학 세포 : 전기 화학적 세포는 자발적인 화학 반응을 통해 전기 에너지를 생산할 수있는 시스템입니다.
전해 세포 : 전해 세포는 전기 에너지가 화학 반응을 만들기 위해 사용될 수있는 전기 화학적 세포의 한 유형입니다.
에너지 변환
전기 화학 세포 : 전기 화학적 세포에서 화학 에너지는 전기 에너지로 전환됩니다.
전해 세포 : 전해 세포에서 전기 에너지는 화학 에너지로 전환됩니다.
외부 전류
전기 화학 세포 : 전기 화학 세포는 외부 전기 에너지 원이 필요하지 않습니다.
전해 세포 : 전해 세포는 외부 전기 에너지 원이 필요합니다.
화학 반응
전기 화학 세포 : 전기 화학 세포에서 자발적인 화학 반응이 발생합니다.
전해 세포 : 전해 세포에서, 비 완전 화학 반응이 발생합니다.
전극
전기 화학 세포 : 전기 화학 셀에서 양극은 음수이고 음극은 양수입니다.
전해 세포 : 전해 세포에서 양극은 양수이고 음극은 음수입니다.
전자 이동
전기 화학 세포 : 전자는 전기 화학 세포에서 양극에서 음극으로 전달됩니다.
전해 세포 : 전자는 배터리에서 캐소드로 전달 된 다음 전자는 전해 세포의 전해 용액을 통해 양극으로 들어갑니다.
결론
전해 세포는 전기 화학 셀의 한 유형입니다. 따라서, 전해 세포는 전형적인 전기 화학 셀이 보유한 모든 성분으로 구성된다. 전기 화학 세포와 전해 세포 모두 시스템을 통한 전자의 순환을 포함합니다. 그러나, 전기 화학적 세포에서, 자발적 화학 반응이 발생하는 반면, 전해 세포에서 비 단성 화학 반응이 일어난다. 이것이 전기 화학 세포와 전해 세포의 차이입니다.