주요 차이 - 완전한 연소 대 불완전한 연소
연소 반응은 연료의 산화에 의해 에너지를 방출하는 화학 반응입니다. 에너지를 방출하는 화학 반응을 발열 반응이라고합니다. 따라서, 연소 반응은 발열이다. 연료는 산화제로 산화 될 수 있습니다. 대부분의 연소 반응에 대한 산화제는 대기 산소입니다. 연소 반응에서 방출되는 에너지는 열 또는 빛 일 수 있습니다. 에너지는 주로 열 형태로 방출됩니다. 빛 에너지는 또한 불꽃으로 방출됩니다. 연소는 완전한 연소와 불완전한 연소로 두 가지 방식으로 발생할 수 있습니다. 완전한 연소와 불완전한 연소의 주요 차이점은 완전한 연소에서 이산화탄소가 탄소를 포함하는 유일한 제품 인 반면 불완전한 연소에서 일산화탄소 및 탄소 먼지는 제품으로 형성된다는 것입니다.
형성된 주요 영역
1. 완전한 연소가 무엇인가
- 정의, 속성, 예
2. 불완전한 연소 가란 무엇입니까
- 정의, 속성, 예
3. 완전한 연소와 불완전한 연소의 유사점은 무엇입니까
- 일반적인 기능의 개요
4. 완전한 연소와 불완전한 연소의 차이점은 무엇입니까
- 주요 차이점 비교
주요 용어 :이산화탄소, 일산화탄소, 연소, 발열 반응, 불꽃, 연료, 산화제, 산화제
완전한 연소
완전한 연소는 연료의 완전한 산화입니다. 이 반응은 매우 발열 적이며 많은 양의 에너지와 제한된 수의 제품을 생성합니다. 연료 연소 또는 연소에서, 연료의 탄화수소는 대기 산소에 의해 산화되어 이산화탄소를 제공한다 (Co 2 ) 및 물 (H 2 o) 제품으로. 완전한 연소는 충분한 양의 산소가 존재하는 경우에 발생합니다. 산소가있는 경우, 탄화수소의 탄소 원자는 이산화탄소로 산화 될 수 있고 수소는 물로 산화됩니다. 완전 연소에 대한 일반적인 반응은 다음과 같습니다.
탄화수소 +산소 → 이산화탄소 +물
에탄올과 같은 연료의 경우, 완전한 연소는
로 제공 될 수 있습니다.c 2 h 5 오 (l) +3o 2 (g) → 2co 2 (g) +3H 2 o (l)
완전한 연소 반응은 연료에 존재하는 탄소, 황 및 기타 요소의 산화물을 초래합니다. 탄소는 이산화탄소로 산화되는 반면 황은 이산화황으로 산화된다. 완전한 연소로 인해 대기 오염 물질이 적습니다. 완전한 연소는 일반적으로 푸른 불꽃으로 특징 지을 수 있습니다.

그림 01 :완전한 연소에서 파란색 불꽃이 생성됩니다.
대기는 부피별로 21% 산소로 구성되기 때문에 완전한 연소가 이루어지기 위해서는 많은 공기가 필요합니다. 완전한 연소로 인한 제품의 양은 낮지 만 여전히 바람직하지 않은 배출량을 추가합니다. 예를 들어, 이산화탄소는 지구 온난화를 유발하는 온실 가스입니다.
불완전한 연소
불완전한 연소는 연료의 부분 산화를 포함하는 화학 반응입니다. 불완전한 연소는 불충분 한 양의 산소가있는 곳에서 발생합니다. 여기서 연료는 불완전하게 산화됩니다. 따라서 불완전한 연소는 다수의 부산물을 형성합니다. 그러나이 연소에서 방출되는 에너지의 양은 비교적 낮습니다. 불완전한 연소의 주요 제품에는 일산화탄소 (CO), 탄소 먼지 (우리는“그을음”) 및 물 (h 2 가 포함됩니다. 영형). 불완전한 연소를위한 일반적인 공식은 다음과 같습니다.
탄화수소 +산소 → 일산화탄소 +탄소 +물
부산물은 연소에 관여하는 산소의 양에 따라 다를 수 있습니다. 예를 들어, 때로는 일산화탄소 또는 그을음 만 생성합니다. 그러나 일반적으로 물과 일산화탄소와 그을음의 혼합물을 제공합니다.
예를 들어, 에틸렌의 불완전한 연소
c 2 H 4 (l) +o 2 (g) → 2c (s) +2H 2 o (g)
에탄올의 불완전한 연소는 물과 함께 일산화탄소와 탄소 먼지를 형성 할 수 있습니다.
c 2 h 5 오 (l) +2o 2 (g) → 2co (g) +3H 2 o (l)
c 2 h 5 오 (l) +o 2 (g) → c (s) +3H 2 o (l)

그림 2 :불완전한 연소로 노란 불꽃이 생성됩니다.
불완전한 연소에는 노란색 불꽃이 특징입니다. 불완전한 연소에서 방출되는 에너지의 양은 낮기 때문에 바람직하지 않습니다. 또한,이 연소에 의해 생성 된 일산화탄소는 대기 오염 물질이며 인체에 치명적입니다. 일산화탄소는 혈액에서 헤모글로빈과 결합하여 신체 내부의 산소 수송을 제한 할 수 있습니다.
완전한 연소와 불완전한 연소 사이의 유사성
- 완전한 연소와 불완전한 연소는 발열입니다.
- 그들은 에너지 형태로 열과 빛을 생성합니다.
- 두 반응 모두 물을 부산물로 제공합니다.
- 두 연소 유형은 연료의 산화를 포함합니다.
- 이러한 반응은 분자 산소와 연료의 조합을 포함합니다.
- 이 연소 반응 모두 불리한 가스 배출을 초래합니다.
- 그들은 불타는 동안 불꽃을 형성 할 수 있습니다.
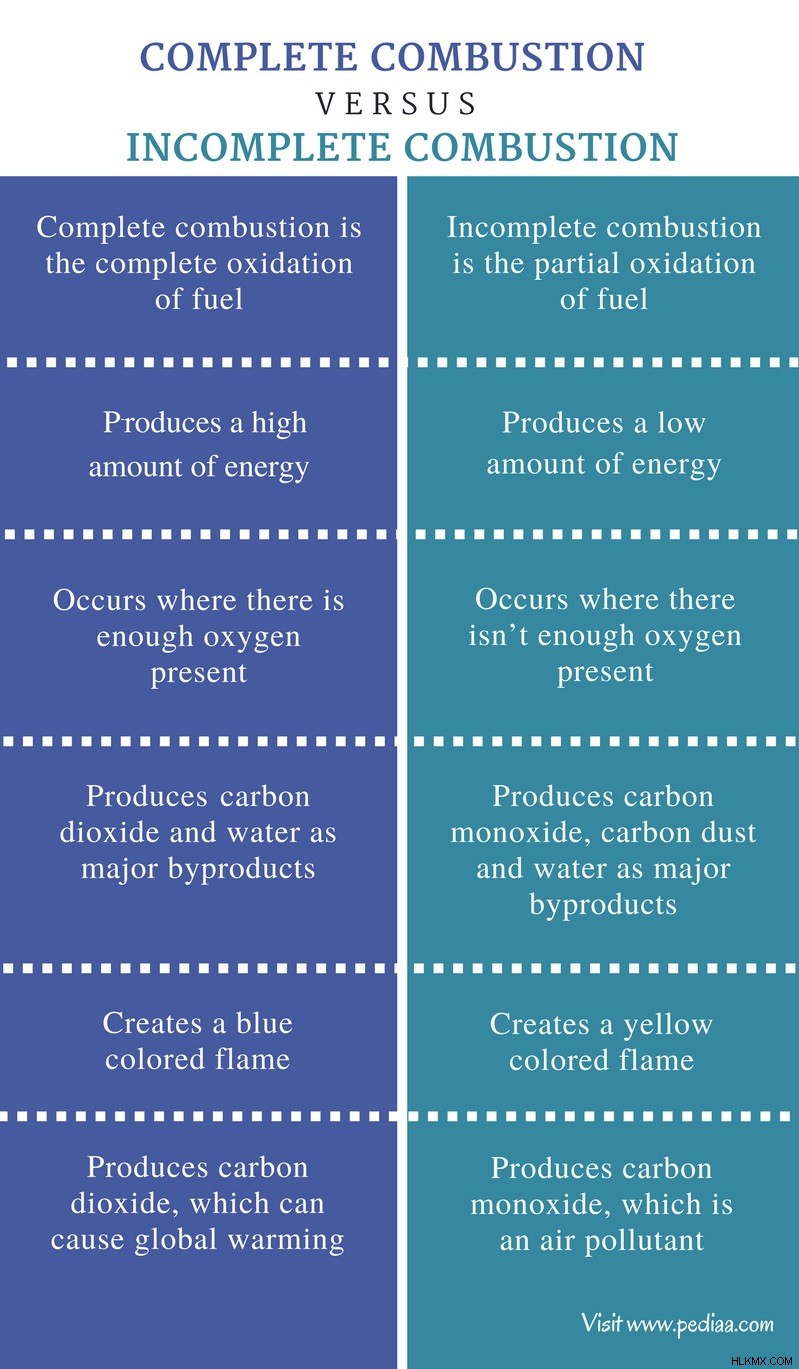
완전한 연소와 불완전한 연소의 차이
정의
완전한 연소 : 완전한 연소는 연료의 완전한 산화입니다.
불완전한 연소 : 불완전한 연소는 연료의 부분 산화입니다.
에너지 방출
완전한 연소 : 완전한 연소는 많은 양의 에너지를 생성합니다.
불완전한 연소 : 불완전한 연소는 적은 양의 에너지를 생성합니다.
관련 산소 양
완전한 연소 : 충분한 산소가있는 곳에서 완전한 연소가 발생합니다.
불완전한 연소 : 불완전한 연소가 충분하지 않은 곳에서 발생합니다.
부산물
완전한 연소 : 완전한 연소는 주요 부산물로 이산화탄소와 물을 생산합니다.
불완전한 연소 : 불완전한 연소는 주요 부산물로 일산화탄소, 탄소 먼지 및 물을 생성합니다.
불꽃
완전한 연소 : 완전한 연소는 푸른 색의 불꽃을 만듭니다.
불완전한 연소 : 불완전한 연소는 노란색 불꽃을 만듭니다.
환경에 미치는 영향
완전한 연소 : 완전한 연소는 지구 온난화를 유발할 수있는 이산화탄소를 생성합니다.
불완전한 연소 : 불완전한 연소는 대기 오염 물질 인 일산화탄소를 생성합니다.
결론
연소 반응은 연료가 연소 될 때 에너지를 방출하는 발열 반응입니다. 연료의 완전한 연소는 많은 양의 에너지를 생성하는 반면 불완전한 연소는 적은 양의 에너지를 산출합니다. 이것이 완전한 연소와 불완전한 연소의 주요 차이점입니다. 완전한 연소는 산업 규모의 응용 분야에서 매우 중요합니다. 불완전한 연소는 요리를위한 열 에너지를 만들기 위해 나무를 태우기 위해 나무를 태우는 것과 같은 가정의 요구에 사용됩니다. 연소에 여러 가지 용도가 있어도 대기 오염 물질로 작용할 수있는 환경에 불리한 가스가 방출됩니다.
.