주요 차이 - 하이브리드 궤도 대 분자 궤도
궤도는 전자로 채워질 수있는 가상 구조입니다. 다른 발견에 따르면, 과학자들은이 궤도에 대해 다른 모양을 제안했습니다. 궤도에는 원자 궤도, 분자 궤도 및 하이브리드 궤도의 세 가지 주요 유형이 있습니다. 원자 궤도는 원자의 핵 주위에 위치한 가상 궤도입니다. 분자 궤도는 두 원자가 이들 사이에 공유 결합을 만들 때 형성된 가상 궤도이다. 하이브리드 궤도는 원자 궤도의 하이브리드 화로 인해 형성되는 가상의 궤도이다. 하이브리드 궤도와 분자 궤도의 주요 차이점은 하이브리드 궤도는 동일한 원자에서 원자 궤도의 상호 작용에 의해 형성되는 반면 분자 궤도는 두 가지 원자의 원자 궤도의 상호 작용에 의해 형성된다는 것입니다.
주요 영역을 다루었습니다
1. 하이브리드 궤도는 무엇입니까
- 형성, 모양 및 특성
2. 분자 궤도는 무엇입니까
- 형성, 모양 및 특성
3. 하이브리드 궤도와 분자 궤도의 유사점은 무엇입니까
- 일반적인 기능의 개요
4. 하이브리드 궤도와 분자 궤도의 차이점은 무엇입니까
- 주요 차이점 비교
주요 용어 :안티 본딩 분자 궤도, 원자 궤도, 결합 분자 궤도, 하이브리드 화, 하이브리드 궤도, 분자 궤도

하이브리드 궤도
하이브리드 궤도는 공유 결합을 만들기 위해 동일한 원자에서 원자 궤도의 혼합으로 인해 형성된 가상의 궤도입니다. 다시 말해, 원자의 원자 궤도는 화학적 결합에 적합한 궤도를 만드는 하이브리드 화를 겪습니다. 원자 궤도는 궤도, p 궤도, d 궤도 및 궤도로 발견됩니다. 둘 이상의 궤도의 혼성화는 새로운 하이브리드 궤도를 형성 할 것이다. 하이브리드 궤도는 하이브리드 화를 겪는 원자 궤도에 따라 명명됩니다. 몇 가지 예는 다음과 같습니다.
SP 하이브리드 궤도
이 궤도는 하나의 궤도와 하나의 p 궤도가 혼합 될 때 형성됩니다. 결과 하이브리드 궤도는 S 특성의 50%와 P 특성의 50%를 갖는다. SP 궤도의 공간 배열은 선형입니다. 따라서,이 궤도 사이의 결합 각은 180c이다. SP 혼성화를 겪는 원자에는 2 개의 빈 P 궤도가 있습니다.
SP 하이브리드 궤도
이 궤도는 하나의 궤도와 2 p 궤도가 혼성화 될 때 형성됩니다. 결과 하이브리드 궤도는 S 문자의 약 33%와 P 문자의 약 66% 를가집니다. 이 궤도의 공간 배열은 삼각 평면이다. 따라서,이 궤도 사이의 결합 각은 120C이다. 이 혼성화를 겪는 원자에는 1 개의 빈 궤도가 있습니다.
SP Orbital
이 궤도는 하나의 궤도와 3 p 궤도가 혼성화 될 때 형성됩니다. 결과 하이브리드 궤도는 S 문자의 약 25%와 P 특성의 약 75% 를가집니다. 이 궤도의 공간 배열은 사면체입니다. 따라서,이 궤도 사이의 결합 각은 109.5C이다. 이 하이브리드 화를 겪는 원자에는 빈 p 궤도가 없습니다.
SPD orbital
이 궤도는 하나의 궤도, 3 p 궤도 및 하나의 궤도가 혼성화 될 때 형성됩니다. 이 궤도의 공간 배열은 삼각 평면이다. 이 혼성화를 겪는 원자에는 4 개의 빈 D 궤도가 있습니다.
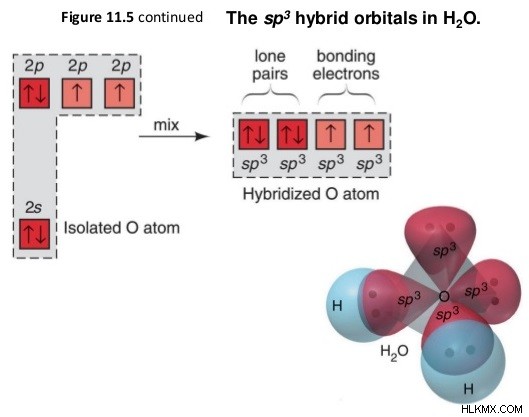
그림 1 :H 2 의 SP 혼성화 o 분자
위의 이미지는 2 개의 수소 원자와 2 개의 공유 결합을 형성하기 위해 산소 분자의 원자 궤도의 혼성화를 보여줍니다.
분자 궤도는 무엇입니까
분자 궤도는 상이한 원자의 원자 궤도의 혼합 (중첩)로 인해 형성되는 가상의 궤도이다. 이것은 두 원자 사이에 공유 결합이 형성 될 때 발생합니다. 예를 들어, 공유 결합이 A와 B 원자 사이에 형성되는 경우, 올바른 대칭을 갖는 원자 궤도가 혼합되어 분자 궤도를 형성합니다. 따라서, 분자 궤도는 대부분의 결합 전자가 두 원자 사이에서 발견 될 수있는 영역이다. 분자 궤도는 결합 궤도 및 안티본 궤도로 두 가지 유형으로 발견 될 수 있습니다.
본딩 분자 궤도
이 궤도는 분자 궤도의 형성을 겪는 원자 궤도와 비교할 때 에너지가 적습니다. 따라서 이러한 궤도는 안정적입니다. 본드 전자 쌍은이 궤도에서 찾을 수 있습니다.
안티 본딩 분자 궤도
이 궤도는 원자 궤도와 결합 분자 궤도보다 에너지가 더 높습니다. 따라서 그들은 덜 안정적입니다. 대부분의 경우,이 궤도는 비어 있습니다.
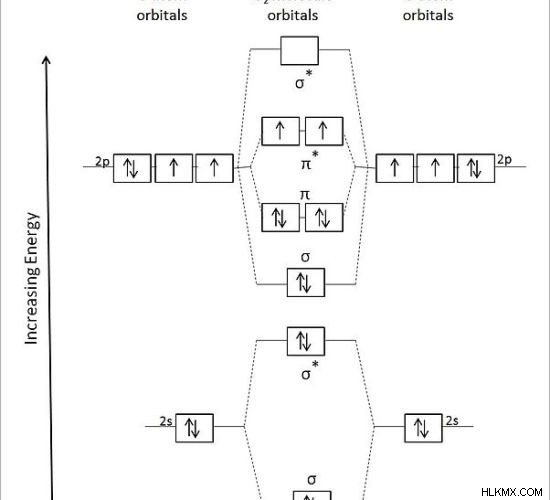
그림 2 :o 2의 분자 궤도 다이어그램 분자
위의 이미지는 이원성 산소에 대한 분자 궤도 다이어그램을 보여줍니다. "σ"기호는 시그마 결합 분자 궤도를 나타내고 "σ*"는 항비 궤도를 나타냅니다.
하이브리드 궤도와 분자 궤도 사이의 유사성
- 원자 궤도의 혼합으로 인해 하이브리드 궤도 및 분자 궤도가 형성됩니다.
- 두 가지 유형의 궤도는 결합 전자 쌍의 가장 가능성있는 위치를 보여줍니다.
하이브리드 궤도와 분자 궤도의 차이
정의
하이브리드 궤도 : 하이브리드 궤도는 공유 결합을 만들기 위해 동일한 원자에서 원자 궤도의 혼합으로 인해 형성된 가상 궤도이다.
.분자 궤도 : 분자 궤도는 상이한 원자의 원자 궤도의 혼합 (중첩)로 인해 형성되는 가상의 궤도이다.
원자
하이브리드 궤도 : 하이브리드 궤도는 동일한 원자에서 형성됩니다.
분자 궤도 : 분자 궤도는 두 원자 사이에 형성됩니다.
안티 본딩 궤도
하이브리드 궤도 : 하이브리드 궤도는 안티 본딩 궤도에 대한 정보를 제공하지 않습니다.
분자 궤도 : 분자 궤도는 안티 본딩 궤도에 대한 정보를 제공합니다.
결론
하이브리드 궤도와 분자 궤도는 모두 원자 또는 원자 사이에서 전자의 가장 가능성이 높은 전자 위치를 나타내는 가상의 궤도입니다. 그것들은 분자의 모양을 예측하는 데 매우 중요합니다. 하이브리드 궤도와 분자 궤도의 주요 차이점은 하이브리드 궤도가 동일한 원자에서 원자 궤도의 상호 작용에 의해 형성되는 반면 분자 궤도는 두 가지 다른 원자의 원자 궤도의 상호 작용에 의해 형성된다는 것입니다.
.