주요 차이 - 두더지 대 분자
두더지와 분자는 화학에 사용되는 두 가지 용어입니다. 두더지라는 용어는 그램이나 밀리그램과 같은 단위로 측정 할 수없는 양을 나타내는 데 사용됩니다. 따라서 두더지는 원자, 이온 또는 분자의 수를 측정합니다. 분자는 화학적 결합을 통한 여러 원자의 조합으로 인해 형성되는 화학 종이다. 분자는 전하를 가지고 있지 않습니다. 분자를 축적하는 원자는 동일한 요소 또는 다른 원소 일 수 있습니다. 이들 원자 사이의 비는 한 분자와 다른 분자와 다릅니다. 시스템에 존재하는 분자의 수는 몰로 측정 될 수 있습니다. 두더지와 분자의 주요 차이점은 두더지가 양의 측정 단위이고 분자는 원자로 만들어진 화학 종입니다.
주요 영역을 다루었습니다
1. 두더지는 무엇입니까
- 정의, 역사적 배경, 응용 프로그램
2. 분자는 무엇입니까
- 정의, 유형 및 사용
3. 두더지와 분자의 차이점은 무엇입니까
- 주요 차이점 비교
주요 용어 :Atom, Avogadro의 숫자, 이온, 두더지, 분자
두더지
두더지는 12.0g의 C 동위 원소에 동일한 수의 원자가 존재하는 수량입니다. 두더지의 값은 6.023 x 10으로 제공됩니다.이 값을 Avogadro의 숫자라고합니다. 즉, 12.0 g의 C 동위 원소는 6.023 x 10 탄소 원자로 구성됩니다. 다시 말해, 탄소의 두더지는 하나의 아보 가드로 수의 탄소 원자로 구성됩니다.
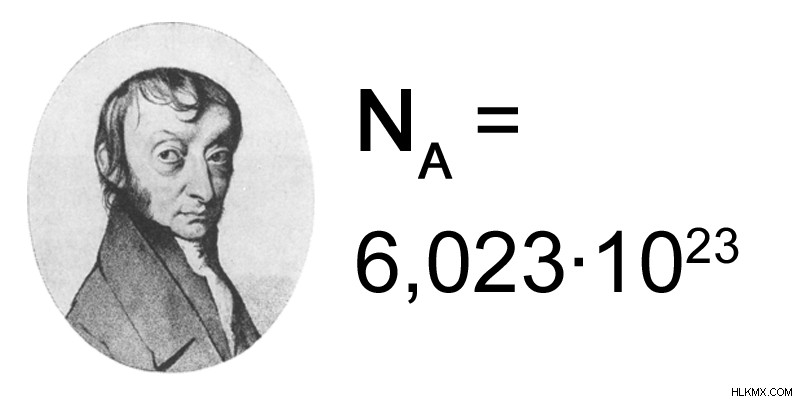
그림 1 :Avogadro의 번호
"mol"단위로 두더지의 수를 제공 할 수 있습니다. 두더지라는 용어는 원자, 분자, 이온 등과 같은 모든 화학 종과 함께 사용될 수 있습니다. 따라서 한 몰의 황은 1 몰의 황 원자를 의미합니다. 1 몰의 이산화탄소 평균, 1 mol of co 2 분자.
원자 레벨에 관해서는 그램이나 밀리그램과 같은 단위가 매우 유용하지 않습니다. 1805 년에 John Dalton은 수소와 관련하여 각 요소의 원자 중량으로 구성된 첫 번째 표준 원자 중량 테이블을 제시했습니다. 수소의 원자 중량은 1로 취해졌다. 따라서, 이들은 상대적 원자 질량이었다. 나중에, 원자 이론의 발전으로, 두더지의 개념은 독일 과학자 인 Wilhelm Ostwald에 의해 소개되었습니다. 그 이후로, 두더지는“mol”으로 상징되는 기본 SI 장치가되었습니다.
두더지는 화학 반응에서 일반적으로 사용되는 용어입니다. 일정량의 반응물에 의해 얻을 수있는 생성물의 양은 반응물과 화학 반응의 생성물 사이의 두더지 비율을 결정함으로써 예측 될 수있다. 원자 무게는 해당 요소의 한 몰의 질량으로 주어집니다. 그렇지 않다면, 아주 미세한 값이기 때문에 원자의 무게를 다루는 것은 매우 어렵습니다.
예를 들어,
산소 1 개 원자의 중량 =2.6 x 10 kg.
산소 1 몰은 6.023 x 10 산소 원자
산소 1 몰의 중량 =(2.6 x 10 x 6.023 x 10)
=15.9 g으로 구성됩니다.
산소의 원자 질량 =15.9 g/mol.
15.99 (약 16)와 같은 값을 처리하는 것은 2.6 x 10 g을 처리하는 것보다 쉽습니다. 따라서 두더지의 개념은 연구에서 매우 중요합니다.
분자
분자는 화학적 결합을 통한 여러 원자의 조합으로 인해 형성되는 화학 종입니다. 이들 결합은 공유 결합, 이온 결합 또는 배위 결합 일 수있다. 이러한 원자의 조합은 동일한 원소 또는 다른 원소의 원자를 포함 할 수 있습니다. 또한, 분자에서 이들 원자 사이의 비율은 해당 분자에 고유하다. 조합이 변경되면 새로운 분자가 발생합니다. 예를 들어, o 2 분자, o 3 입니다 또한 분자입니다. 그러나 그것들은 다른 분자입니다.
단일 원자는 분자가 아닙니다. 화합물은 여러 다른 원소로 만들어진 분자입니다. 따라서, 일부 분자는 H 2 와 같은 하나의 원소의 원자로 구성되기 때문에 모든 분자는 화합물이 아닙니다. 및 o 2 .
그림 2 :분자는 단순한 분자 또는 복잡한 분자로 발견 될 수 있습니다.
위의 이미지는 공유 결합을 통해 서로 부착 된 많은 수의 원자로 구성된 복잡한 분자를 보여줍니다.
분자는 이원성 분자, 삼중 학적 분자 등으로 찾을 수 있습니다. 분자는 이온 결합 또는 공유 결합을 가질 수 있습니다. 예를 들어, NaCl 분자는 Na와 Cl 원자 사이에 이온 성 결합을 갖는다. 그래서
두더지와 분자의 차이
정의
두더지 : 두더지는 12.0g의 C 동위 원소에 동일한 수의 원자가 존재하는 양의 양입니다.
분자 : 분자는 화학적 결합을 통한 여러 원자의 조합으로 인해 형성되는 화학 종입니다.
응용
몰 : 두더지는 물질의 양을 측정하는 데 사용됩니다.
분자 : 분자는 여러 원자의 조합을 지명하는 데 사용됩니다.
단위
몰 : 두더지는 단위 "mol"에 주어진다.
분자 : 분자의 수는 존재하는 "mol"의 수로 측정 할 수 있습니다.
결론
두 용어 몰과 분자는 뚜렷한 용어이지만, 두더지의 개념은 샘플에 존재하는 분자의 양을 측정하는 데 사용될 수 있습니다. 두더지와 분자의 주요 차이점은 두더지가 양의 측정 단위이고 분자는 원자로 만들어진 화학 종입니다.