주요 차이 - 원자 번호 대 질량 수
원자는 전자, 양성자 및 중성자로 구성됩니다. 양성자와 중성자는 함께 원자의 핵을 만듭니다. 원자의 질량을 측정 할 때 실제로 핵의 질량을 측정합니다. 그것은 전자의 질량이 양성자 또는 중성자와 비교할 때 무시할 수 있기 때문입니다. 원자 수와 원자의 질량 수는 두 가지 중요한 용어입니다.이 용어는 원자에 존재하는 양성자 수와 중성자 수에 대한 세부 사항을 제공하기 때문입니다. 주요 차이 원자 수와 질량 수는 원자 수가 원자에 존재하는 양성자 수를 나타내는 반면 질량 수는 양성자 수와 원자에 존재하는 수 중성자를 나타냅니다. .
주요 영역을 다루었습니다
1. 원자 번호
- 정의, 예제에 대한 설명
2. 질량 번호
- 정의, 예제에 대한 설명
3. 원자 번호와 질량 수의 차이점은 무엇입니까
- 주요 차이점 비교
주요 용어 :원자, 원자 번호, 전자, 동위 원소, 질량 수, 중성자, 핵, 양성자

원자 번호
원자 번호는 원자에 존재하는 양성자 수입니다. 양성자는 원자의 핵에 있습니다. 원자의 양성자 수는 화학 요소의 독특한 특성입니다. 따라서, 우리는 원자에 존재하는 양성자 수를 찾아서 주어진 화학 요소를 식별 할 수 있습니다. 각각의 모든 원자에는 하나 이상의 양성자가 있습니다. 예를 들어, 수소 원자는 단 하나의 양성자를 가지고 있습니다.
원자 번호는 양성자 수이므로 원자 번호에는 단위가 없습니다. 예를 들어, 헬륨의 양성자 수는 2입니다. 따라서 헬륨의 원자 수는 2입니다. 일반적으로 원자가는 특정 방식으로 화학 요소의 상징과 함께 제공됩니다. 예는 다음과 같습니다.

그림 1 :원자 번호는 화학 기호 앞에서 소문자 번호로 제공됩니다.
동위 원소는 양성자 수가 같지만 중성자 수가 다른 원자입니다. 이들 동위 원소는 수의 양성자 수를 가지기 때문에 동일한 화학 요소에 속합니다. 그러므로 우리가 동위 원소에 대해 이야기 할 때, 우리는 같은 요소의 다른 형태에 대해 이야기하고 있습니다.
양성자는 긍정적으로 하전 된 하위 원자 입자입니다. 따라서 원자 수는 핵의 총 양전하를 나타냅니다. 중성 원자에서, 양성자의 수는 전자의 수와 같다. 중성이 되려면 모든 양의 전하는 전자의 음전 전하로부터 중화되어야하기 때문이다. 따라서 원자 수는 중성 원자에 존재하는 전자 수와 같습니다.
해당 요소가 방사성 인 경우 요소의 원자 번호를 변경할 수 있습니다. 일부 원소가 방사능을 겪을 때 양성자는 상이한 아 원자 입자로 전환되거나 중성자가 양성자로 전환 될 수 있기 때문이다. 어느 쪽이든, 그것은 원자에 존재하는 양성자의 수를 변경합니다. 이것은 다른 요소로 변경됩니다 (원자 번호의 변화는 요소를 변경합니다).
질량 번호
질량 번호는 양성자 수와 원자의 중성자의 합입니다. 이것은 질량 수가 원자의 핵에 존재하는 총 원자 입자의 총 수임을 의미합니다. 양성자 또는 중성자 단독을 핵이라고합니다. 따라서, 질량 수는 또한 원자의 핵에 존재하는 총 핵의 수로 주어질 수있다.
이것은 원자의 질량을 결정하기 때문에 질량 번호라고합니다. 원자의 MAS는 양성자의 총 질량과 그 원자의 중성자입니다. 그것은 전자의 질량이 양성자 또는 중성자와 비교할 때 무시할 수 있기 때문입니다.
양성자의 수와 중성자 수는 안정적인 원자에서 동일하기 때문에 원자의 질량 수는 원자 수의 두 배입니다. 그러나 동위 원소에서 질량 수는 원자 수의 두 배나 같을 수도 있고 동일하지 않을 수 있습니다. 동위 원소의 양성자 수는 같지만 다른 수의 중성자가 있기 때문입니다. 따라서 질량 수는 예상 값과 다릅니다.
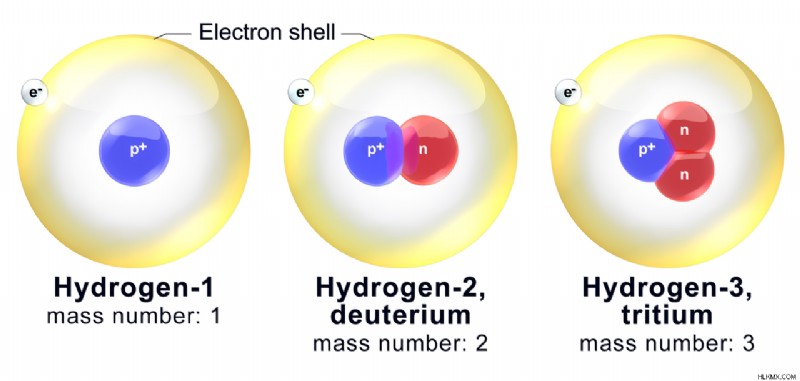
그림 2 :수소의 주요 동위 원소와 질량 수
그 외에도 isobars라는 물질이 있습니다. 이들은 질량 수가 동일한 원소의 원자이지만 원자 숫자는 다릅니다. 예를 들어, 염소 -37 및 아르곤 -37은 동일한 질량 수를 갖는다. 따라서 그들은 isobars입니다.
원자가 종종 방사성 핵에서 두 개의 양성자와 2 개의 중성자를 제거하는 알파 붕괴를 겪으면서 질량 수의 원소가 그에 따라 변경 될 수 있습니다. 그런 다음 질량 수는 4 단위로 변경됩니다.
원자 번호와 질량 수의 차이
정의
원자 번호 : 원자 번호는 원자에 존재하는 양성자 수입니다.
질량 수 : 질량 수는 양성자 수와 원자의 중성자의 합입니다.
중성자 수
원자 번호 : 중성자의 수는 원자의 원자 수에 영향을 미치지 않습니다.
질량 수 : 중성자의 수는 원자의 질량 수에 영향을 미치지 않습니다.
동위 원소
원자 번호 : 동위 원소는 동일한 원자 번호를 갖습니다.
질량 수 : 동위 원소는 질량 수가 다릅니다.
이소 바르
원자 번호 : 이소 바는 동일한 원자 번호를 가질 수 없습니다.
질량 수 : 이소 바르는 질량 수가 같다.
값
원자 번호 : 원자 번호는 항상 질량 수보다 작은 값입니다.
질량 수 : 질량 수는 항상 원자 번호보다 큰 값입니다.
결론
원자 번호와 질량 번호는 원자에 대한 기본 세부 사항입니다. 원자 번호는 특정 화학 요소의 고유 한 값입니다. 그러나 질량 수가 같은 요소가있을 수 있습니다. 그들은 이소 바르라고합니다. 또한, 다른 질량 수를 가진 동일한 원자 수를 갖는 원자가있을 수 있지만, 동일한 요소에 속하는 원자가있을 수있다. 그들은 동위 원소라고합니다. 원자 수와 질량 수의 주요 차이점은 원자 수는 원자에 존재하는 양성자 수를 나타내는 반면 질량 수는 양성자 수와 원자에 존재하는 수 중성자를 나타냅니다.
.






![은하수의 가장 밝은 별 패치 이미지 [환상적인 천체]](/article/uploadfiles/202211/2022111014564884_S.jpg)